纳米技术和光学分子成像在癌症的早期诊断与治疗中发挥着重要的作用。基于癌症发生的特点与遗传改变的差异,设计性能优良的多功能纳米载体和靶向给药新策略,是实现癌症个体化治疗的必由之路。
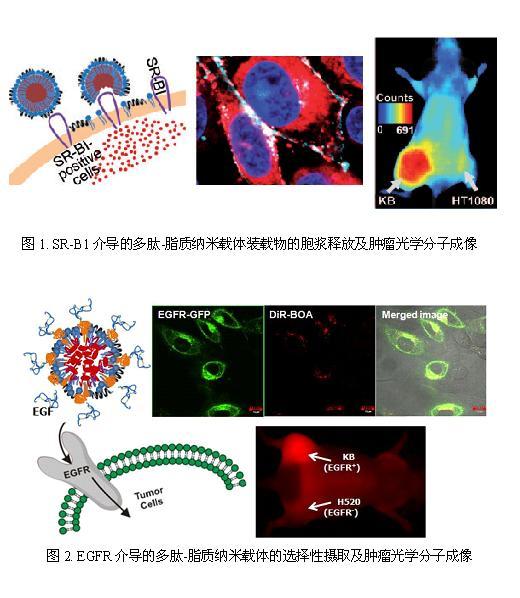
武汉光电国家实验室(筹)Britton Chance生物医学光子学研究中心张智红教授与加拿大多伦多大学/安大略癌症研究院郑岗副教授经过多年的合作研究,针对目前纳米载体在肿瘤治疗应用中存在的一些问题(如生物相容性、纳米尺寸、装载效率、靶向性等),共同发明了一种超小粒径(小于30 nm)的多肽-脂质纳米载体,用于肿瘤的光学成像诊断与靶向治疗。此多功能纳米载体具有以下特点:1)生物相容性好;2)靶向性可变更;3)纳米尺寸在10-30 nm间可调;4)分散度和稳定性好;5)亲水性和亲脂性分子均能有效装载并隐藏到球形纳米颗粒的核心内;6)体内循环半衰期长(~13小时)。上述特点使得纳米载体能够在实体瘤内充分扩散,从而将装载物(荧光探针或药物)有效地运输到肿瘤组织的中心部位。用于组装纳米载体的两亲性多肽,不仅能有效地控制纳米尺寸,还具有介导纳米载体将装载物直接释放到肿瘤细胞胞浆中的功能,这对于细胞内活性药物(如siRNA、多肽类药物等)的肿瘤靶向运输具有重要意义。上述研究成果作为Hot Paper发表在2009年Angewandte Chemie International Edition上(Biomimetic Nanocarrier for Direct Cytosolic Drug Delivery. Angewandte Chemie International Edition. 48(48), 9171-9175)。关于多肽-脂质纳米载体的靶向性变更和协同靶向功能方面的研究成果发表在2010年Small上(HDL-mimicking peptide-lipid nanoparticles with improved tumor targeting. Small. 6(3), 430-437)。
在上述合作研究成果的基础上,双方实验室共同申请了国家自然科学基金委员会(NSFC)——加拿大卫生研究院(CIHR)健康研究合作计划项目,题为“ 基于癌症遗传改变的光学分子成像引导的癌症治疗”(项目批准号:30911120489)。双方将在未来的三年里共同发展适合于个体医疗的光学分子成像引导的癌症治疗技术。具体为,发展无免疫原性的HER2/neu受体靶向的脂蛋白纳米颗粒,作为载体将抗癌药物紫杉醇(PTX)和近红外荧光染料DiR(ICG的类似物)选择性地同步运输到癌细胞内。在此基础上,应用在体光学层析分子成像技术直接监测癌症的生长、转移、治疗和消退过程,动态反馈癌症治疗效应,及时调整治疗方案。预计本项目所产生的成果,将充分展现如何利用脂蛋白纳米颗粒作为定制的靶向运输载体,同步携带大剂量化疗药物和光学探针直接作用于恶性病变细胞,通过光学分子成像监测抗癌药物到达肿瘤的准确剂量及其在体内的分布与代谢,从而实现癌症治疗过程中的同步“ 可视与可治”。
(责任编辑:陈智敏)