2019年2月4日,《自然·通讯》(Nature Communications)在线发表了华中科技大学武汉光电国家研究中心张智红教授课题组的最新研究成果“蜂毒纳米颗粒免疫调控肝血窦内皮细胞抑制肿瘤肝转移” (Immune modulation of liver sinusoidal endothelial cells by melittin nanoparticles suppresses liver metastasis, Nature Communications, 2019, 10:574)。
肝脏是机体执行重要生理功能的器官,也被认为是一种免疫器官,含有独特的内皮细胞及免疫细胞亚群,构成区域性免疫耐受微环境,由此成为肿瘤转移的高发器官。肝血窦内皮细胞(LSEC)是肝脏组织特异性的血管内皮细胞,不仅是构成肝血窦壁的主要成分,同时也广泛参与肝脏的各种生理功能(如免疫调节、肝脏再生和肝脏代谢)和病理过程(如肝脏纤维化和肝硬化等)。LSEC在维持肝脏的免疫耐受微环境中发挥着重要作用,靶向调节LSEC对于改善其参与的病理过程具有潜在的价值。然而,目前尚无活体内高效靶向LSEC的方法,限制了特异性调控LSEC的相关研究。针对此难点,张智红教授、骆清铭教授和博士研究生余祥等人,建立了靶向标记与免疫调控LSEC的新方法,通过特异性激活LSEC以改变肝脏免疫微环境,成功阻断了多种肿瘤的肝转移发生。
研究发现,含有RKR 多肽序列的蜂毒肽纳米颗粒(α-melittin-NP)可高效靶向LSEC并诱导其免疫激活。研究者应用显微光学成像技术动态监测蜂毒肽纳米颗粒对LSEC的靶向过程,活体动物的肝脏成像结果显示荧光标记的α-melittin-NP静脉注射后,LSEC迅速被点亮(~20s),并能维持长达12 h的靶向标记能力。LSEC细胞转录组测序结果表明,纳米颗粒作用后的LSEC免疫相关分子mRNA 水平显著升高,GO富集分析显示差异性表达基因主要涉及免疫细胞趋化及淋巴细胞激活等。研究者结合流式细胞术和液相多因子联检技术,在蛋白水平上证实α-melittin-NP作用后的LSEC高表达共刺激分子(CD80、CD86、MHC-Ⅱ)、分泌细胞因子(如IL-18、IL-12等)以及趋化因子(如CXCL9、CXCL10等)。由此,α-melittin-NP打破了LSEC介导的免疫耐受状态,招募NK和T细胞的肝脏浸润,进而促进NK细胞的分化成熟和T细胞激活,致使肝脏由免疫耐受状态转变为免疫激活状态,有效阻止多种肿瘤(黑色素瘤、乳腺癌、结肠癌)的实验性肝转移和乳腺癌自发性肝转移的发生。该研究成果解决了LSEC高效靶向标记及特异性调控的难题,提出以LSEC为靶标调控肝脏免疫微环境的新方法,为肿瘤肝转移的治疗提供了新策略。
该研究工作得到了国家重点研发计划(2017YFA0700403),国家杰出青年科学基金(81625012), 国家自然科学基金委员会创新研究群体科学基金(61721092)和国家自然科学基金重大研究计划(91442201)等项目的资助。张智红教授和骆清铭教授为论文共同通讯作者,博士研究生余祥为第一作者,陈璐、刘剑桥、代博雷、许国强为共同作者参与相关工作,沈关心教授参与研究工作的指导。
全文链接:https://www.nature.com/articles/s41467-019-08538-x
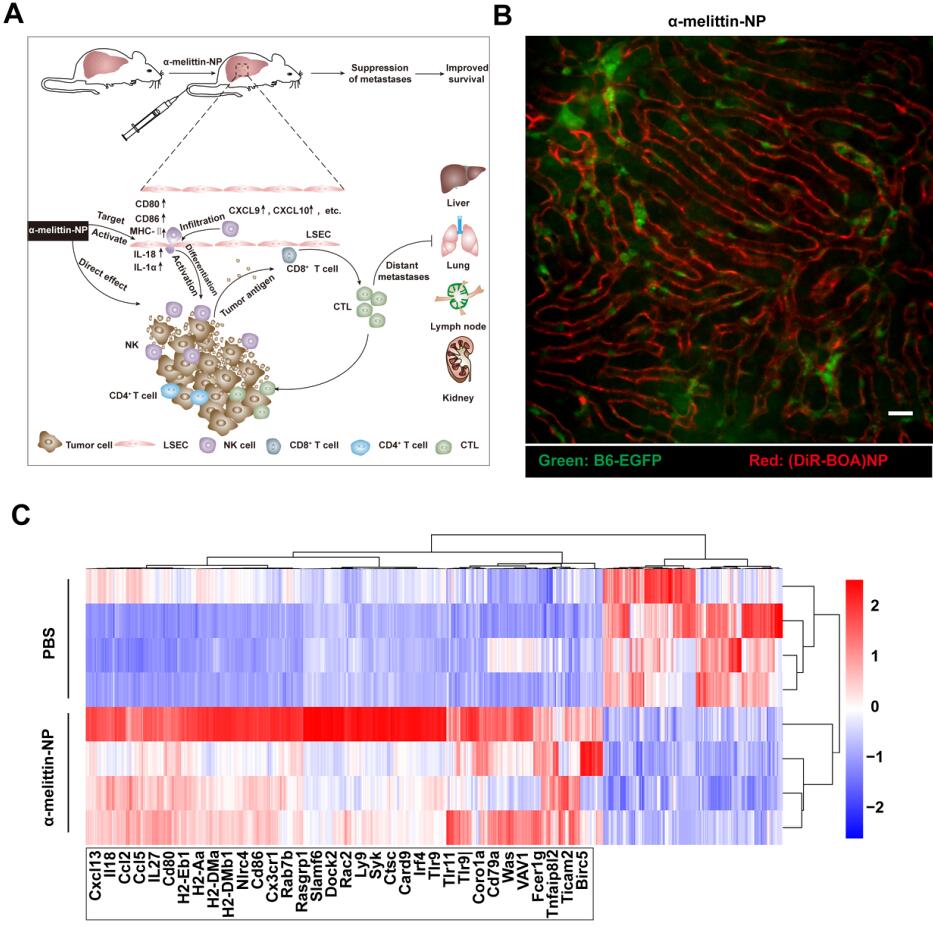
图:肝血窦内皮细胞的靶向标记与免疫调控。(A)α-melittin-NP通过特异调控LSEC抑制肿瘤肝转移的机制示意图; (B)活体荧光成像监测α-melittin-NP对LSEC的靶向标记能力,标尺为20 μm;(C)LSEC上调及下调的差异性基因热图。