计算模型揭示Aβ介导的星形胶质细胞钙信号可为AD治疗提供新思路
阿尔兹海默症(Alzheimer’s disease,AD),俗称老年痴呆,是最为广泛而典型的神经系统退行性疾病。据统计,全球现有超过5000万人患有痴呆症,预计到2050年这一数字将超过1.5亿,给患者和社会造成严重的经济负担。目前,人们对AD的发病原因知之不足,因而没有可行的治愈方法。已有研究提示:星形胶质细胞是AD病因及进展中的重要角色,其钙离子(Ca2+)信号(如钙振荡)直接相关。
鉴于此,武汉光电国家研究中心生物医学光子学功能实验室陈尚宾副教授课题组提出了一个星形胶质细胞中Ca2+失调的AD特异性模型。该模型将多个关键的Ca2+机制整合到单个细胞模型框架中。β淀粉样蛋白(Aβ)可以在膜上形成通孔并增加L型钙离子电压门控通道(L-Type VGCC)电导,造成大量Ca2+内流。可溶性的Aβ寡聚物能进入到胞内,影响三磷酸肌醇(IP3)的产量,导致钙诱导钙释放(CICR)过程受影响。Aβ还会提高雷诺丁受体(RyR)的敏感性,影响Ca2+从内质网释放。通过计算仿真,量化分析了每种Ca2+流机制对AD的可能贡献;模拟了靶向不同信号途径的药物治疗效果,发现单一治疗的局限性并提出了针对AD晚期有效的“联合治疗”方法。

图1. AD中星形胶质细胞钙信号失调机制与阻断治疗方法
基于动力学系统分岔分析显示,Aβ形成的透过性通孔对正常钙振荡的破坏作用最大,一旦进入稳态,钙离子迅速积累,引起钙中毒。

图2. 胞内Ca2+浓度对Aβ水平的分岔图
通过改变通道或者受体的参数模拟药物作用,结果表明:在疾病的不同阶段,阻断Aβ通孔都是最有效的方法,而阻断VGCC则收效甚微。同时,采用单一治疗的方法在AD晚期并不能得到最好的疗效,需要考虑多信号通道同时干预的“联合治疗”。
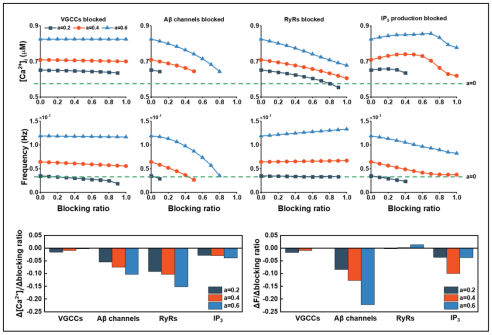
图3. 阻断各通路后钙信号幅度和频率变化
以上相关成果于10月28日发表在Frontiers in Physiology上,论文题目:Unravelling Aβ-mediated multi-pathway calcium dynamics in astrocytes: Implications for AD treatment from simulations。论文链接:https://doi.org/10.3389/fphys.2021.767892。项目得到国家自然科学基金(批准号91749209)、武汉光电国家研究中心主任基金、英国和俄联邦相关项目共同资助。论文作者为刘浪舟(第一作者)、高华一(并列第一作者)、Alexey Zaikin、陈尚宾(通讯作者)。其中,高华一为工程科学学院大四学生。
(通讯员:刘浪舟)