本文介绍的是中国科学院化学研究所方晓红研究员课题组借助于自主搭建的线切换双色STED超分辨显微镜观察到clathrin和caveolae內吞囊泡的融合,发表在《Journal of Innovative Optical Health Sciences》期刊2021年第6期。
Fusion of clathrin and caveolae endocytic vesicles revealed by line-switching dual-color STED microscopy
线切换双色STED超分辨显微镜揭示clathrin和caveolae內吞囊泡的融合
Hefei Ruan, Jianqiang Yu, Yayun Wu, Xiaojun Tang, Jinghe Yuan and Xiaohong Fang
研究背景
光学显微镜凭借其非接触、无损伤、可实时探测生物样品内部等优点,一直是生命科学及相关领域最常用的研究工具,但是由于光学衍射极限的存在,限制了对亚细胞尺度上生理过程的观测和研究。经过近十多年的发展,多种光学超分辨技术已逐渐成熟并广泛应用,尤其是受激辐射耗尽(STED)显微镜凭借其超高分辨率和三维层析能力,成为备受关注的新型成像工具。同时为了深入研究不同生物分子间的相互作用,以更好地理解细胞的生理过程,发展双色甚至多色STED超分辨显微镜具有重要意义。
从光路设计及成像装置上来说,目前科研人员主要通过以下两种方式来实现多色STED成像:(1)选择激发光谱和发射光谱可以截然分离的多种荧光分子进行标记,成像时分别使用多束激发光和多束STED损耗光来实现多色STED超分辨成像;(2)选择激发光谱不同,发射光谱相近的多种荧光分子进行标记,成像时使用多束激发光共用一束STED损耗光的形式实现多色STED成像。然而,无论使用哪种方式实现多色STED成像都可能面临不同通道间的交叉干扰问题,并且第一种方法还会存在通道间图像偏离的问题。
解决通道间交叉干扰(串色,cross-talk)问题有三种常用的方法:(1)光谱分离法,使用滤波片对不同通道的荧光信号进行光谱分离,此方法的光路系统比较简单,容易实现,但是仅靠滤波片难以彻底消除串色问题;(2)图像处理法,是基于相似荧光分子的光谱探测和线性光谱分离法,此方法需要评估每种荧光分子所发出的荧光对每个成像像素点的贡献,然后基于图像处理算法对多通道信号进行分离,属于后期处理技术,但是难以实现多通道的彻底分离,并且易产生假象;(3)时间门分离法,通过添加门控来控制不同成像通道的激发光交替激发样品,同时根据荧光分子的荧光寿命设置时间间隔来进行同步的荧光信号探测,以此抑制双通道同时成像时其他通道荧光信号对自身荧光探测通道的干扰。
目前,已报道的时间门分离法主要有以下两种:其中,由于STED显微镜属于点扫描成像显微镜,可以在同一像素点通过门控(g-STED)方式依次完成多通道的荧光激发、损耗和探测,然后再扫描到下一像素点,可称之为点扫描时间门分离法,点扫描模式需要严格控制单一通道内的荧光激发、损耗和探测顺序,还需要控制多通道之间的门控顺序,该方法虽然能够彻底解决串色问题,但是要求较高的时序脉冲频率,并且对脉冲时序的调控要求极为严格且装置复杂,实现起来比较困难;另外一种时间门分离法使用面扫描成像模式,即实现一个通道的一帧二维图像以后,再进行下一个通道的单帧成像,在单通道成像过程中,其它通道的激发和探测系统关闭,实现交叉干扰的彻底消除,但是这种多色成像模式的缺点是无法实现多色同时成像,并且不同通道之间存在横向漂移,给活细胞和共定位研究带来困难。
内容简介
Clathrin和caveolae介导的內吞途径是大多数细胞膜受体内化的主要方式,但是由于它们的尺寸处于衍射极限内,传统的荧光显微镜无法分辨它们,因此对于它们在细胞膜附近的相互作用知之甚少。在本研究中,我们自主搭建了一套线切换扫描成像模式的双色三重态弛豫(T-Rex)STED超分辨显微镜,并且利用该线切换模式有效地消除了两通道之间的串色、脉冲拾取器产生的副作用和帧扫描模式下的图像漂移问题。凭借该双色T-RexSTED超分辨显微镜出色的超分辨能力(~40纳米),我们不仅可以观察到clathrin和caveolae內吞囊泡的环状结构,还可以清晰地分辨出它们在近膜区的半融合结构。
图文导读
1.线切换扫描成像模式下的激光照明及荧光收集方式
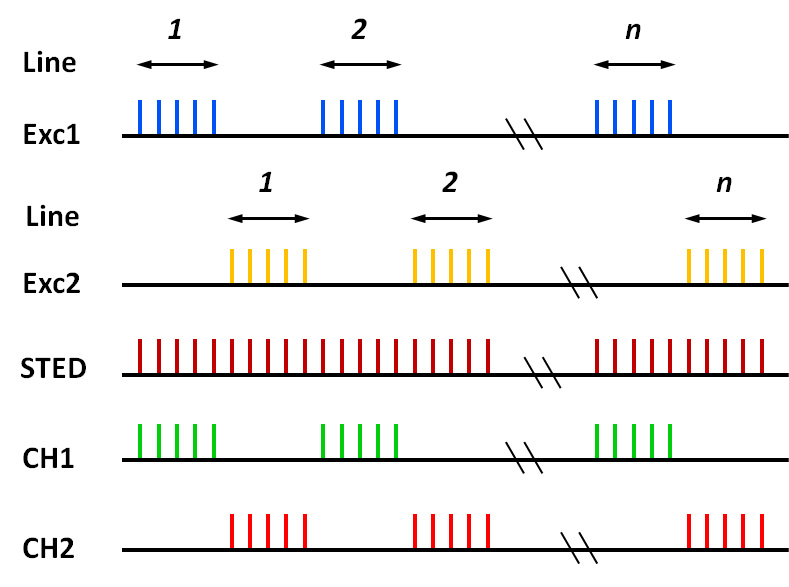
图1:线切换成像模式下的激光脉冲(Exc1、Exc2、STED)和荧光收集(CH1、CH2)的脉冲时序图
工作模式如图1所示:在进行样品扫描成像时,首先进行通道1扫描,通道1激发光(Exc1)开启并进行一条线的扫描激发,通道1的光电探测器(CH1)开启并进行相应的荧光信号收集,与此同时,通道2激发光(Exc2)和光电探测器(CH2)同时关闭;随后进行通道2扫描,开启通道2的激发光(Exc2)对同一条线的样品进行激发并采集信号,期间通道1激发光和CH1同时关闭,其中STED损耗光一直处于开启状态;然后位移台移动到下一条线的样品继续进行两个通道的激发和探测,如此反复,直至完成双通道二维图像的扫描。与基于点扫描模式的时间门分离法相比,基于线扫描模式的时间门分离法仅需在激发光光路中添加快门即可实现,并且不仅从根本上解决了串色问题,还降低了对脉冲时序控制的要求,简化实验装置。
2.验证线切换扫描成像模式解决串色的能力
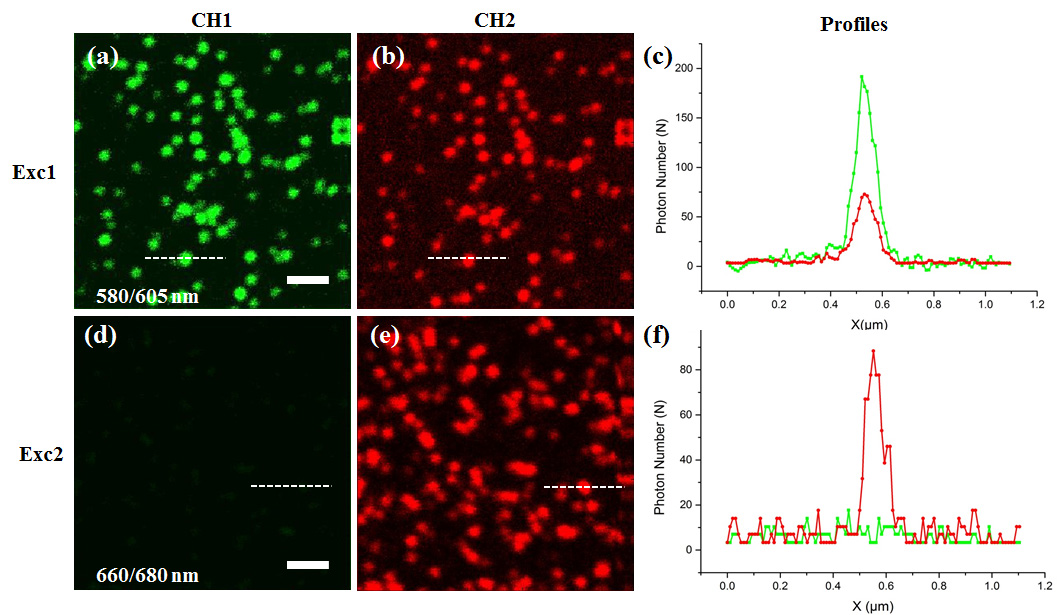
图2:没有线切换扫描模式时两个通道的串色情况。(a,b)共聚焦模式下,使用Exc1的激发光激发通道1(CH1)40纳米的荧光珠子,CH1和CH2同时检测荧光信号。(d,e)使用Exc2的激发光激发CH2的40纳米荧光珠子时,CH1和CH2同时检测荧光信号。(c,f)同一个荧光球在两个通道的荧光强度分布
如图2所示,共聚焦模式下,使用Exc1的激发光激发通道1(CH1)40纳米的荧光珠子,在通道2(CH2)检测到大约30%的CH1的荧光信号。使用Exc2的激发光激发CH2的40纳米荧光珠子时,CH1没有检测到CH2的荧光信号。说明通道1的荧光信号可以串到通道2中,而通道2中的荧光信号不会串到通道1中。

图3:线切换扫描模式下两个通道的串色情况检测。(a,b)是Exc1激发时CH1检测到的共聚焦和STED成像图,(c)是STED成像模式下CH2检测到的荧光信号。(d,e)是Exc2激发时CH2检测到的共聚焦和STED成像图,(f)是STED成像模式下CH1检测到的荧光信号
如图3所示,在线切换扫描成像模式下,通道2不会再检测到通道1的荧光信号,通道1也不会检测到通道2的荧光信号。因此,我们通过在两个激发通道添加机械快门的方式实现线扫描切换模式,成功解决了两个通道间的串色问题。
3.线扫描成像模式下两个通道间的图像漂移问题
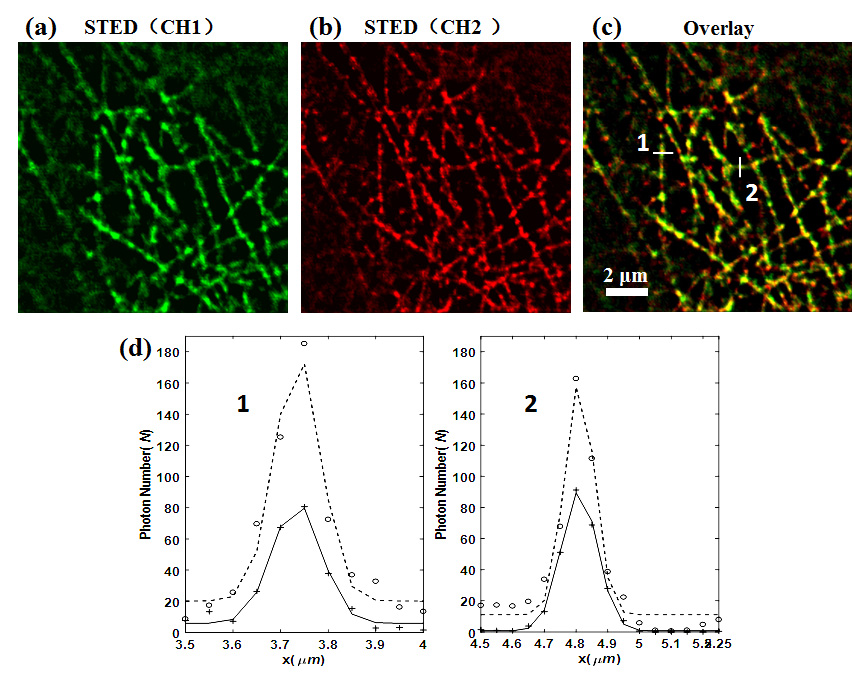
图4:线切换扫描模式下细胞微管的双色STED超分辨共定位分析。(a)细胞微管通道1的STED图,(b)细胞微管通道2的STED超分辨图,(c)是两个通道的叠加图。(d)分别是(c)中位置1和位置2处的横向和纵向位移分析
如图4所示,为了检测线切换扫描模式下两个通道间的图像漂移,我们对细胞微管同时标记两种荧光染料,成像之后分别对两个通道图像进行横向和纵向漂移分析。结果显示,线扫描成像模式下横向和纵向的图像漂移分别为18纳米和3纳米,远远好于帧扫描模式下横向39.7纳米的漂移。
4.线切换扫描模式下混合荧光珠子的双色成像

图5:线切换扫描模式下40纳米混合荧光珠子的双色confocal和STED成像。(a)和(b)分别为通道1和通道2的confocal成像,(d)和(e)分别为两个通道对应的STED超分辨成像图。(c)和(f)分别为对应的两个通道的叠加图
如图5所示,我们使用40纳米的混合荧光珠子来检测线切换扫描模式下双色STED的超分辨成像效果。结果如图5(c)和5(f)所示,confocal模式下不可分辨的两种荧光珠子,而在STED超分辨模式下,我们能更加准确的判断两种荧光珠子的形态和位置关系。因此这种没有串色问题的双色超分辨显微镜为研究不同亚细胞结构、不同生物分子间的相互作用奠定基础。
5.线切换双色STED超分辨成像表征clathrin和caveolae內吞囊泡结构及其半融合模式
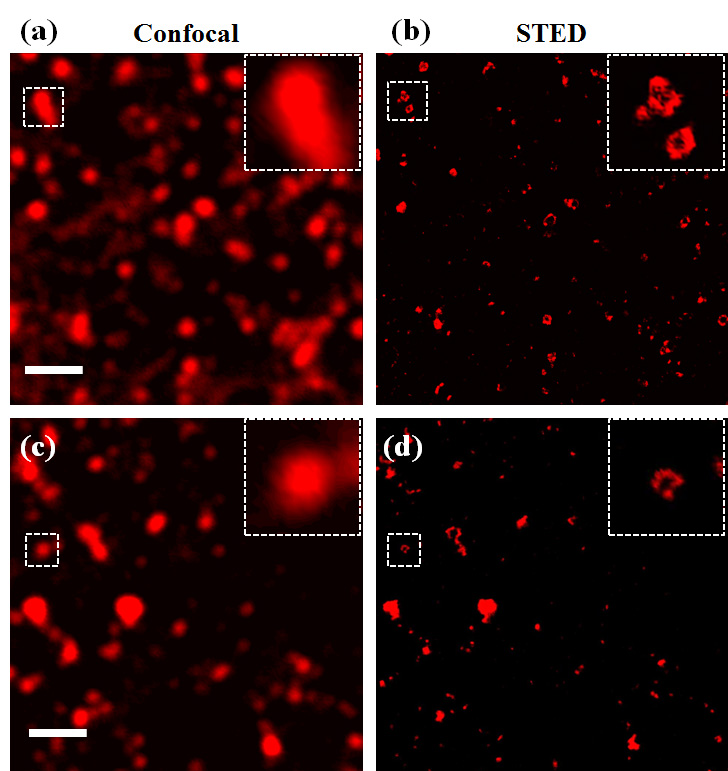
图6: Clathrin和caveolae內吞囊泡的confocal和STED超分辨成像。(a)和(b)分别为clathrin內吞囊泡的共聚焦和STED超分辨成像结果,(c)和(d)分别为caveolae內吞囊泡的共聚焦和STED超分辨成像结果

图7: Clathrin和caveolae內吞囊泡的双色confocal和STED超分辨成像。(a)和(b)分别为clathrin和caveolae內吞囊泡的共聚焦和STED超分辨成像结果,其中绿色为clathrin內吞囊泡,红色为caveolae內吞囊泡
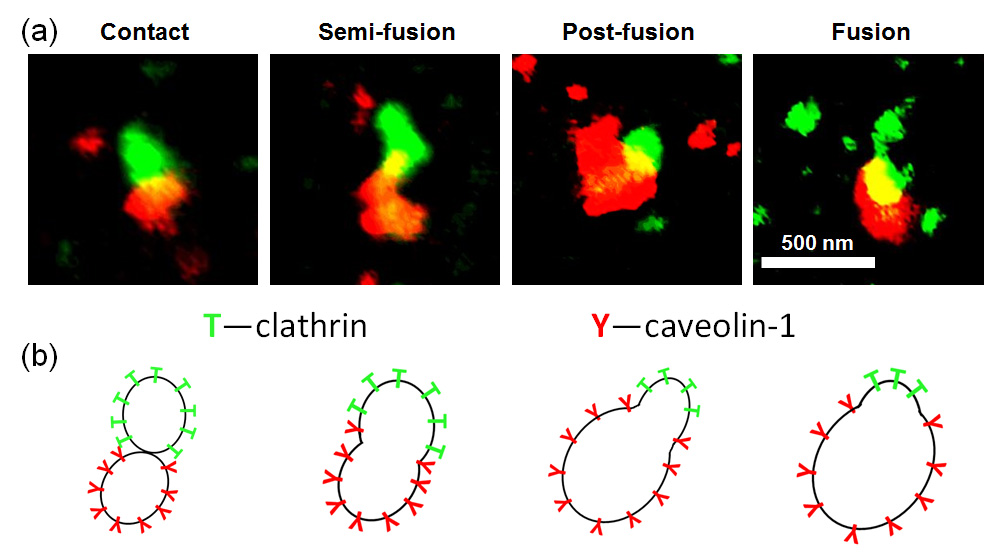
图8:(a)双色STED超分辨成像表征clathrin和caveolae內吞囊泡不同阶段的融合状态。(b)为不同融合阶段的示意图
如图6所示,借助于STED显微镜出色的超分辨能力(~40纳米),我们清晰地观察到clathrin和caveolae內吞囊泡的环状结构,然后我们在线切换扫描模式下,无串色的情况下准确的捕捉到了细胞近膜区clathrin和caveolae內吞囊泡不同阶段的半融合状态(如图7和图8所示),这将为我们进一步研究细胞内转运提供帮助。除此以外,我们提出的线切换扫描双色T-RexSTED超分辨显微镜为在亚细胞尺度上研究不同结构、分子间的位置关系和相互作用提供了一种更加精确和简便的工具。
通讯作者简介

袁景和,研究员。1999年获得四川大学光学专业硕士学位。2002年获得南开大学光学工程专业博士学位。2004年上海光机所国家强光光学重点实验室物理学博士后出站。现为中国科学院化学研究所分子纳米结构与纳米技术重点实验室研究员。主要研究领域包括:生物医学光学成像,图像处理与模式识别。长期从事光学仪器研制,研制的主要仪器包括:超短激光脉冲激光激发的扫描共聚焦显微镜,并利用其实现超分辨STED、CARS和SERS显微成像;基于光学散射的激光微粒计数仪;基于手势和面部识别的人机交互系统;基于人眼识别的操作人员疲劳状态监测系统;基于光学微细加工的光学回归反射器等。现在主要研究领域为超分辨光学成像仪器和单分子数据处理。在显微光学成像、图像处理与模式识别等领域发表论文70余篇,获得国家发明专利8项。

方晓红,中国科学院化学研究所研究员,博士生导师,国家杰出青年基金获得者,科技部重大科学研究计划首席科学家。课题组在发展高灵敏度的生物医学分析新方法、单分子水平研究DNA/蛋白质相互作用力和对蛋白质等生物大分子表征、细胞信号转导相关蛋白的活细胞单分子研究等方面取得了高水平的研究成果。已在PNAS、JACS、Angew. Chem. Int. Ed.、Nat. Microbio.、Nano Lett.、Anal. Chem. 等国际学术期刊上发表论文200多篇。主持和作为主要成员承担和完成了国家自然科学基金委杰出青年基金、重大、重点基金和国家科技部、卫生部等多项科研项目, 2007-2017年两次担任科技部纳米重大科学研究计划项目首席科学家。被推选为国际纯粹与应用化学联合会IUPAC“化学与人类健康”委员会国家代表(2018-2019)、衔称委员(2020-2021)。应邀担任美国化学会Analytical Chemistry 副主编和Int. J. Nanomed.,ChemPhysChem,Sci. China-Chem.,Chin. Anal. Chem.,Chemical Research in Chinese Universities等SCI国际期刊编委。