前言
本文介绍的是中南大学化学化工学院蓝敏焕教授课题组对“供体-受体”结构半导体聚合物用于近红外荧光成像引导的光动力治疗的相关研究,发表在《Journal of Innovative Optical Health Sciences》期刊2022年第4期。
A "donor-acceptor" structured semiconductor polymerfor near infraredfluorescence imaging guidedphotodynamic therapy
“供体-受体”结构半导体聚合物用于近红外荧光成像引导的光动力治疗
Baoling Li, Ting Xu, Xiaosha Wang, Shaojing Zhao, Benhua Wang, Lihui Jiang, Xiangzhi Song and Minhuan Lan*
研究背景
传统的癌症治疗方法,如放疗、化疗和手术治疗,具有副作用大、耐药性高和手术创伤大等问题。荧光成像引导的光动力治疗除了可以有效改善上述问题,还具有低侵袭性、高时空选择性和实时光学监测等优点。荧光成像引导的光动力治疗的基本原理即光敏剂吸收特定波长的光,从而可以从基态(S0)跃迁至激发单重态(S1),随后,处于S1态的光敏剂,一部分可以回到S0态,并以辐射跃迁的形式释放出荧光用于成像,而另一部分可以通过系间窜越跃迁至激发三重态(T1),并进一步敏化氧气产生单线态氧(1O2)用于光动力治疗(PDT)。光敏剂在PDT过程中起着非常重要的作用。常见的无机光敏剂如碳纳米材料、金纳米材料等,存在着在体内难降解,生物毒性高等问题。一般的有机小分子光敏剂如BODIPY、卟啉等虽然有较好的生物安全性,却存在着吸收波长短、光稳定差等缺点,因而不利于深层肿瘤的治疗。半导体聚合物(SPs)包含很多有机分子单元,由于其良好的光学性质和生物安全性而受到了广泛关注。
内容简介
本文设计合成了一种具有供体-受体(D-A)结构的半导体聚合物(SPs),并进一步通过纳米沉淀法包裹于两亲性的化合物F127,从而制备得到半导体聚合物纳米颗粒F-SP NPs。该F-SP NPs具有良好的水溶性、生物相容性,在630 nm处还具有较强的吸收和近红外(NIR)荧光发射的性能,在635 nm激光器激发下,F-SP NPs的单线态氧量子产率高达88.8%。因此,本文将为制备用于荧光成像引导的光动力治疗的半导体聚合物纳米颗粒提供一定的指导作用。
图文导读
1.F-SP NPs的制备及其光动力治疗示意图
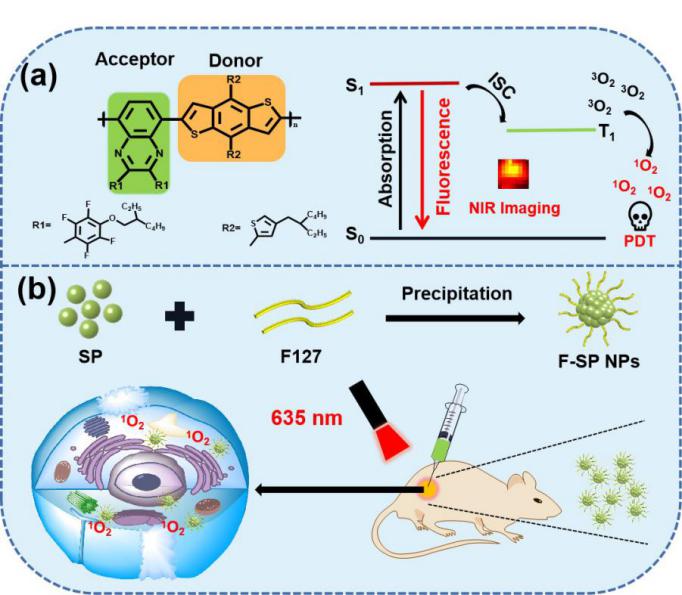
图1:(a)半导体聚合物分子的结构及光疗机理图(b)F-SP NPs的制备及光动力治疗示意图
2.SPs和F-SP NPs的结构及表征
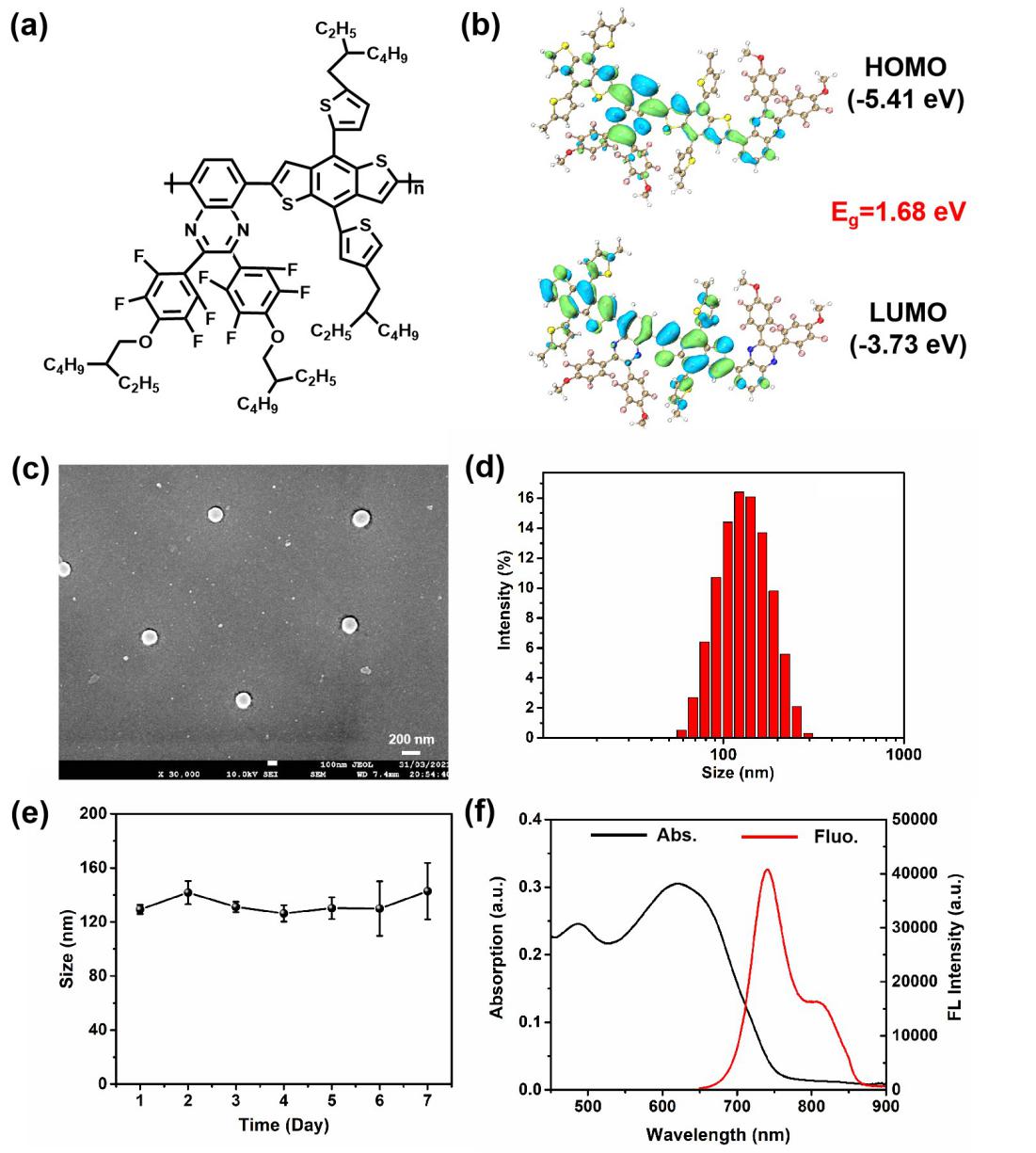
图2:SPs和F-SP NPs的结构及表征。(a)SPs的分子结构。(b)SPs分子的HOMO-LUMO分布。(c)F-SP NPs的扫描电镜(SEM)图。(d)F-SP NPs的DLS粒径分布图。(e)F-SP NPs分散在PBS中的七天内粒径变化。(f)F-SP NPs的吸收光谱(黑线)和荧光发射光谱(红线)
如图2(a),该SPs具有很强的D-A结构,从而可以有效降低HOMO-LUMO之间的能隙(Eg=1.68 eV)。将SPs通过纳米沉淀法包裹两亲性的F-SPs之后,可以得到水溶性良好的半导体聚合物纳米颗粒F-SP NPs。如图2(c)所示,SEM图表明F-SP NPs具有均一稳定的球形形貌,其尺寸约为130 nm。DLS粒径分布也得到了同样的结果(图2d),这样的尺寸有利于肿瘤通过EPR效应对药物进行摄取。同时F-SP NPs在PBS中具有良好的粒径稳定性,七天内没有明显的变化。此外,SPs的D-A结构还可以有效促进分子内电荷转移(ICT),使得光谱红移,如图2(f)所示,F-SP NPs在630 nm处具有很强的吸收峰,同时在750 nm和820 nm处具有很强的荧光发射峰,质量消光系数和荧光量子产率分别为21.7 L/(g·cm)和6.5%,因而可以实现深层肿瘤的近红外荧光成像。
3.F-SP NPs产生单线态氧和热量的性能评估
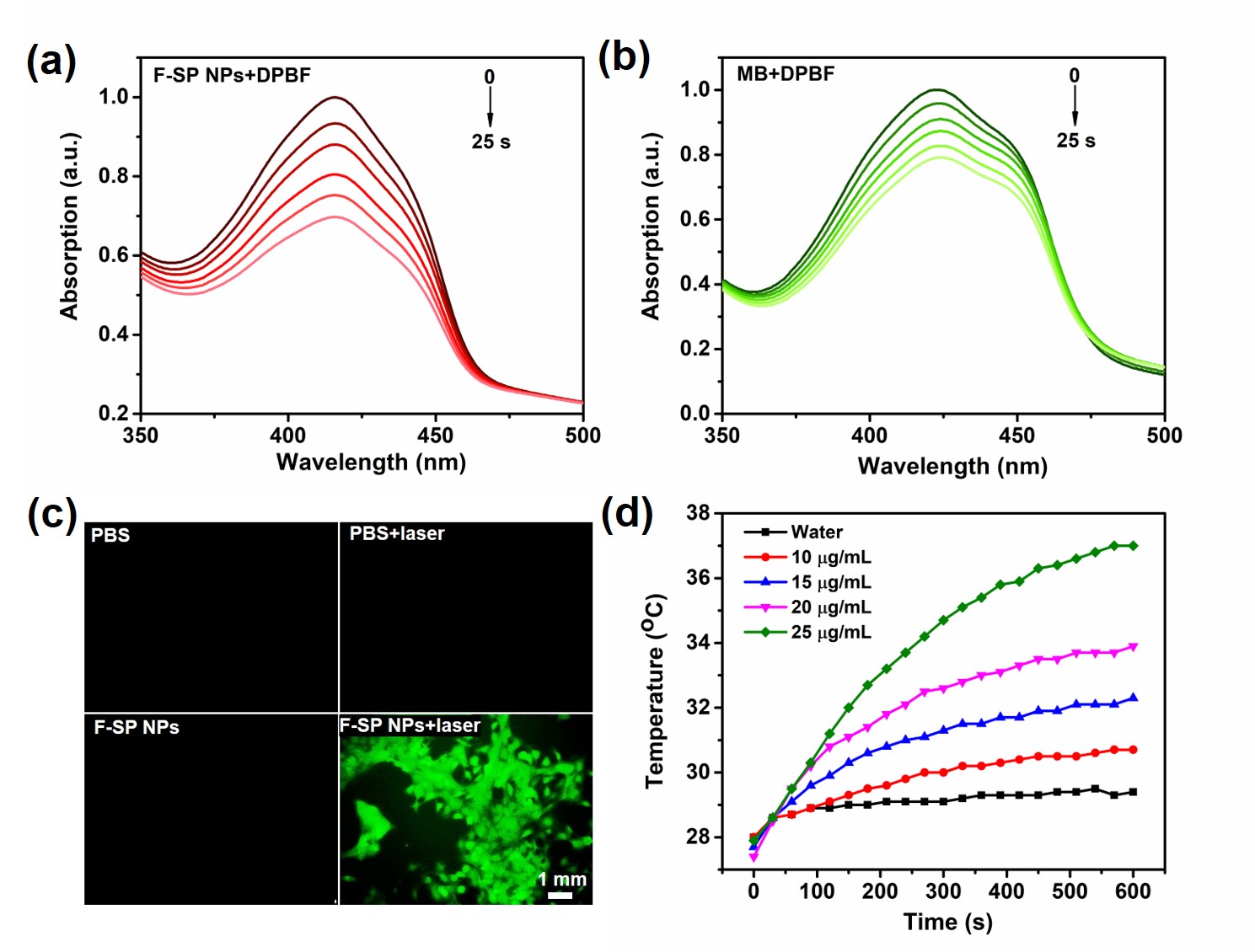
图3:F-SP NPs产生单线态氧和热量的性能评估。DPBF作为探针检测(a)F-SP NPs和(b)MB在激光器照射下产生的单线态氧。(c)DCFH-DA作为探针检测4T1细胞中产生的单线态氧(比例尺为1 mm)。(d)不同浓度F-SP NPs水溶液在激光器照射下的升温情况
如图3(a)和3(b),使用DPBF作为探针,商用光敏剂MB作为参照,F-SP NPs在激光器照射下产生单线态氧的能力明显比MB更强,F-SP NPs的单线态氧量子产率高达88.8%。同时,使用DCFH-DA作为探针,F-SP NPs在635 nm激光器照射下在4T1细胞内也能产生单线态氧,呈现出绿色荧光。此外,如图3(d),不同浓度F-SP NPs在激光器照射下产生的热量变化并不明显,说明光敏剂吸收的光能主要用于敏化氧气产生单线态氧,从而实现高效的光动力治疗。
4.F-SP NPs的光毒性/暗毒性评估

图4:F-SP NPs的光毒性/暗毒性评估。(a)光照(红色柱状图:无VC;绿色柱状图:有VC)和无光照(棕色柱状图)条件下不同浓度F-SP NPs孵育下4T1细胞的存活率。(b)4T1细胞的活死细胞荧光染色(比例尺为1 mm)
图4(a)棕色柱状图表明F-SP NPs具有较小的暗毒性,而红色和绿色柱状图则表明F-SP NPs对4T1细胞具有良好的光动力治疗效果,浓度越高治疗效果越好。图4(b)则通过calcein-AM/PI共染色可视化F-SP NPs在光照条件下对细胞的杀伤力,其中calcein-AM染活细胞,呈现绿色荧光,PI染死细胞,呈现红色荧光,再次表明F-SP NPs具有较大的光毒性。
5.F-SP NPs的体内荧光成像和抗肿瘤性能评估
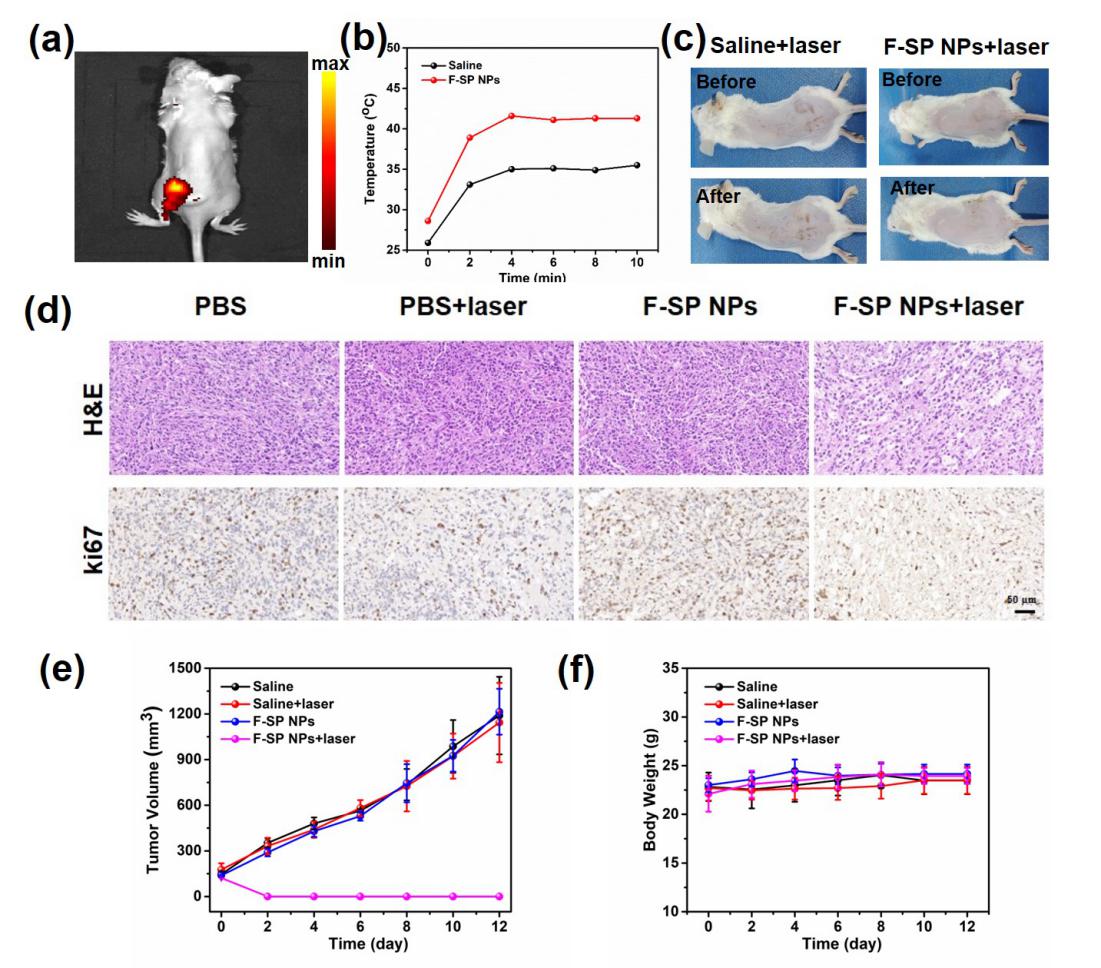
图5:F-SP NPs的体内荧光成像和抗肿瘤性能评估。(a)小鼠肿瘤部位注射F-SP NPs水溶液后的荧光成像。(b)注射生理盐水(黑)或F-SP NPs之后在激光器照射下小鼠肿瘤部位温度变化。(c)注射生理盐水或F-SP NPs光照前后的小鼠照片。(d)不同组小鼠肿瘤部位的H&E和Ki67切片染色(比例尺为50μm)。(e)肿瘤体积及(f)小鼠体重在14天内变化情况
如图5(a),将F-SP NPs注射进入小鼠肿瘤部位后,小鼠肿瘤部位呈现出明亮的近红外荧光,因而可以用于生物体内的近红外荧光成像。图5(b)和5(c)说明F-SP NPs在光照条件下几乎不会产生热量,因而不会对小鼠的正常组织造成伤害。图5(d)组织的H&E和Ki67切片染色表明F-SP NPs在光照条件下可以对肿瘤组织造成较大的损伤,同时可以有效抑制肿瘤细胞的增殖。对肿瘤体积(图5(e))变化进行12天记录,结果表明F-SP NPs+光照组的肿瘤在治疗之后就消失了,其他三组对照组的小鼠肿瘤则持续增长。同时,各组小鼠的体重均未出现明显的变化,说明F-SP NPs不会对小鼠造成其他的副作用。
通讯作者简介

蓝敏焕, 男,博士,中南大学化学化工学院特聘教授,博士生导师。2007年于中央民族大学毕业,获理学学士学位,2013年于中国科学院理化技术研究所毕业,获理学博士学位,并获中国科学院院长优秀奖。2013-2017年 在香港城市大学超金刚石与先进薄膜研究中心(COSDAF)担任高级研究助理。主要从事有机、无机发光材料的设计、合成及在生物/环境等领域的应用(主要包括荧光探针、生物成像、光诊疗及光催化)。在Nat. Commun., J. Am. Chem. Soc., Adv. Mater., Nano Research, Chem. Commun.,等国际学术期刊发表研究论文70余篇,申请国内外发明专利11项,包括2项国际专利,6项中国授权专利。主持国家自然科学基金(青年、面上)、湖南省重点研发计划、深圳市科创委、中南大学创新驱动计划以及企业委托技术开发等项目10余项。