本文介绍的是福建医科大学刘景丰教授和刘小龙教授课题组开发的一种具有聚集诱导发光AIE特性的BODIPY光敏剂,可自组装形成纳米颗粒用于肿瘤荧光成像引导下的光动力治疗,论文发表在《Journal of Innovative Optical Health Sciences》期刊2022年第6期。
A novel BODIPY-based nano-photosensitizer withaggregation-induced emission for cancerphotodynamic therapy
一种具有聚集诱导发光特性的新型BODIPY纳米光敏剂用于肿瘤的光动力治疗
Yuting Zhang, Guojing Li, Jiong Li, Ming Wu, Xiaolong Liu, and Jingfeng Liu
研究背景
光动力治疗(PDT)的侵入性小,特异性高,可控性好,且毒副作用低,已被广泛研究并用于多种类型肿瘤的临床治疗。光敏剂是光动力治疗的关键要素之一,传统光敏剂往往受限于聚集诱导淬灭效应,量子产率低,而聚集诱导发光(AIE)材料为光敏剂的开发提供了新思路。此外,在AIE分子骨架上引入电子供体-受体-供体(D-A-D)构型,不仅可以提高ROS产率,还能使分子的吸收和发射波长红移,有助于组织深层肿瘤的成像和治疗。因此,本文开发了一种兼具D-A-D分子结构和AIE效应的新型BODIPY光敏剂,用于肿瘤荧光成像引导下的光动力治疗。
内容简介
本文合成了一种具有AIE特性的BODIPY光敏剂(ET-BDP-O)。该光敏剂以BODIPY为核心,两侧与三苯胺基团连接,中间修饰三甘醇单乙醚侧链,形成D-A-D分子构型。ET-BDP-O能够自组装形成约125 nm左右的纳米颗粒,粒径大小均匀,性质稳定。由于AIE效应,ET-BDP-O纳米颗粒在外源光激发(60 mW/cm2)下,不仅可以大量生成ROS,还能够发射出明亮的荧光信号。在细胞水平上,ET-BDP-O纳米颗粒能够被肿瘤细胞有效摄取,受激后发射的红色荧光可用于生物成像,且对肿瘤细胞表现出强烈的光毒性。
图文导读
1.光敏剂ET-BDP-O的合成
图1(a)展示了光敏剂ET-BDP-O的合成过程,最终得到以BODIPY为母核和电子受体、两端偶联三苯胺为电子受体和AIE结构基团、侧链修饰三甘醇单乙醚为亲水基团的新型AIE光敏分子。该分子结构经过核磁共振氢谱进行了验证(图1(b))。
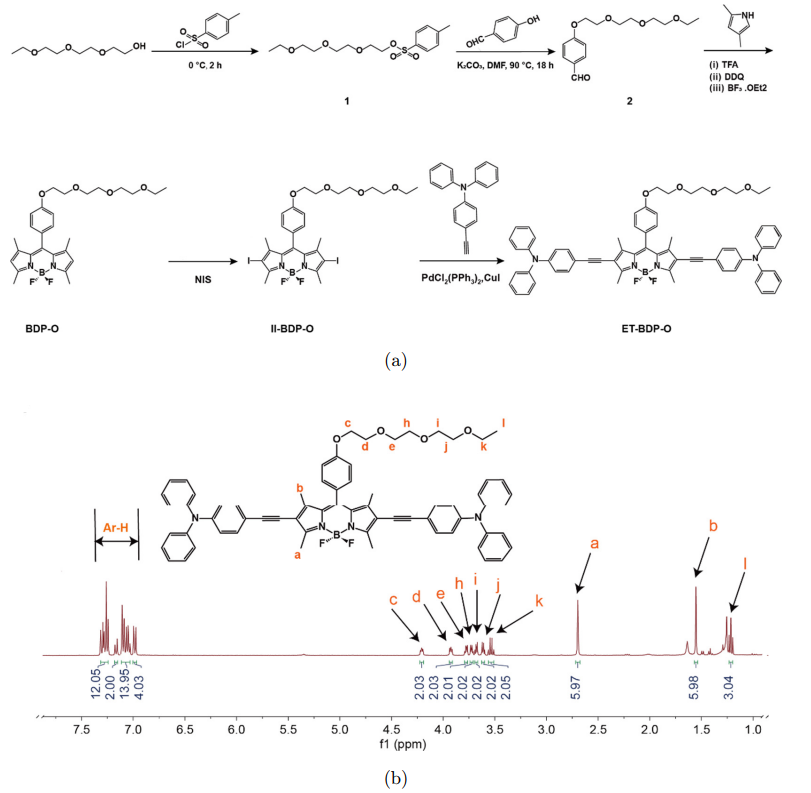
图 1 :(a)ET-BDP-O的合成步骤;(b)核磁共振图谱
2.ET-BDP-O纳米颗粒的制备与表征
如图2所示,ET-BDP-O可通过纳米沉淀法自组装形成纳米颗粒,其平均粒径为125±0.9 nm,表面电势为-27.4mV,且在水溶液中储存6天后,其粒径和分散性均无明显改变。上述实验结果表明ET-BDP-O纳米颗粒具有良好的分散性和胶体稳定性。
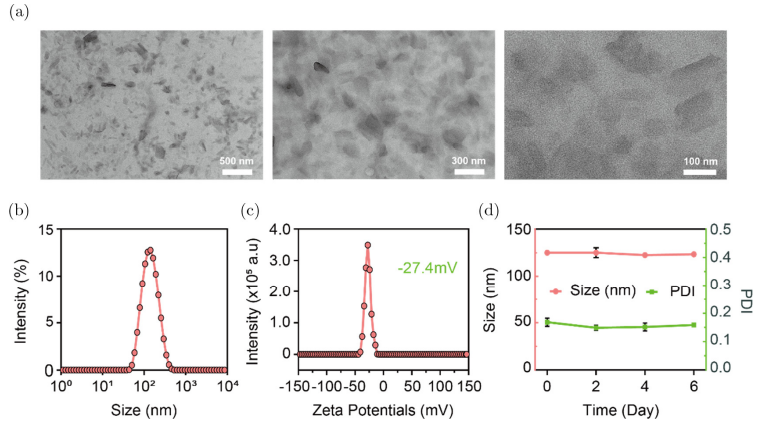
图2:ET-BDP-O纳米颗粒的表征。(a)透射电镜。(b)粒径分布。(c)表面电势分布。(d)粒径和PDI变化
3.ET-BDP-O纳米颗粒的光物理性质
如图3(a)和3(b)所示,光敏剂ET-BDP-O及其形成的纳米颗粒均具有相似的特征吸收和荧光发射光谱。且储存6天后,ET-BDP-O纳米颗粒的吸收光谱无明显变化(图3(c)和3 (d)),证明材料的光学稳定性较好。此外,如图3(e)和3(f)所示,对ET-BDP-O在不同比例H2O/四氢呋喃THF(0-90%,v/v)混合溶液中的发光性质进行研究,结果表明,在水含量从0%上升到40%时,由于分子内扭转电荷转移,材料的荧光强度逐渐下降,而当水含量上升到50-70%时,ET-BDPO分子会发生聚集,导致分子内运动受限使得荧光强度增强,但当水含量大于70%时,由于无定形颗粒的形成,又会造成荧光强度的减弱。
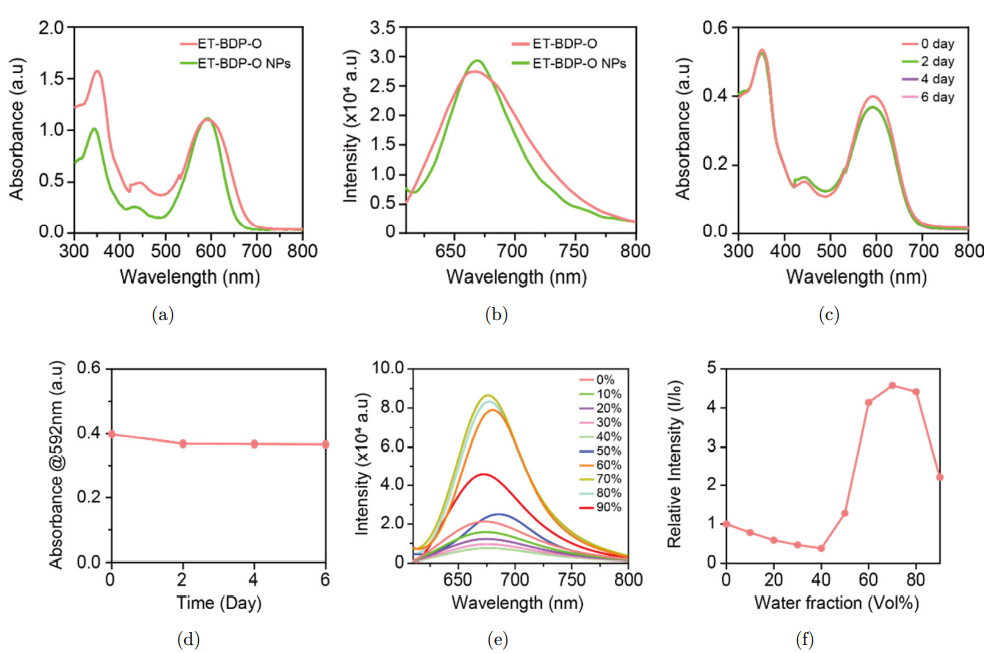
图3. ET-BDP-O纳米颗粒的光学特性。(a) 吸收光谱。(b) 荧光光谱。(c) 不同时间点的吸收光谱,及(d)在592 nm处的吸光度。(e) 不同比例H2O/THF混合溶液中的荧光光谱,及 (f)在675nm处的相对荧光强度
4.ET-BDP-O纳米颗粒的光动力特性
如图4 (a)和4(b)所示,由于ET-BDP-O的分子构型和AIE特性,其在水溶液中发生聚集时,单线态氧1O2和羟基自由基的产率更高。同时,以SOSG为探针检测ET-BDP-O纳米颗粒在不同浓度和光照时间下的1O2生成情况。可以看出,ET-BDP-O的1O2生成能力具有明显的浓度和光照时间依赖性(图4(c)-(g))。
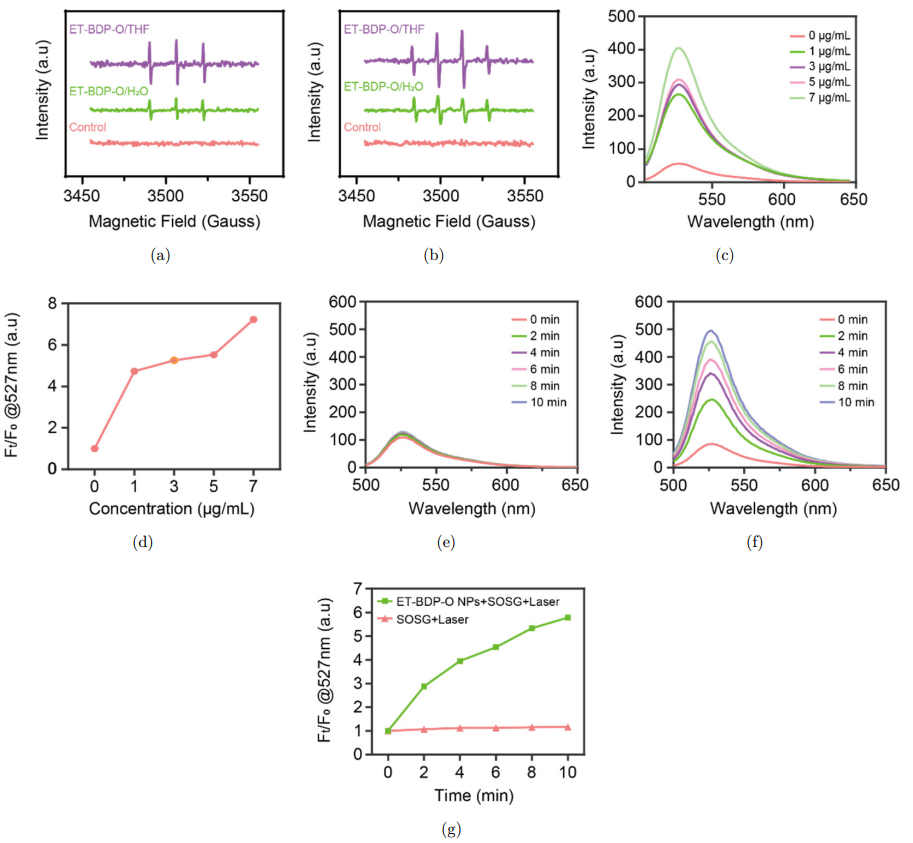
图4: (a)1O2的EPR光谱。(b) 羟基自由基的EPR光谱。(c)不同材料浓度下的SOSG荧光光谱,以及(d) 在527nm处的相对荧光强度。(e-g)不同光照时间下的SOSG荧光光谱,以及在527nm处的相对荧光强度
5.ET-BDP-O纳米颗粒的细胞摄取
如图5所示,随着ET-BDP-O纳米颗粒与肿瘤细胞共孵育时间的增加,细胞内的纳米颗粒(红色荧光信号)不断增多,表明肿瘤细胞对ET-BDP-O纳米颗粒具有良好的摄取能力,且得益于ET-BDP-O的聚集诱导发光能力,可进一步用于细胞的荧光成像。

图5:共聚焦分析肿瘤细胞对ET-BDP-O纳米颗粒的摄取情况
6.ET-BDP-O纳米颗粒的胞内ROS产生性能和体外光动力效果
如图6(a)所示,在外源光照下,ET-BDP-O纳米颗粒可以诱导肿瘤细胞大量产生ROS(绿色荧光信号)。且CCK-8细胞活性检测结果表明,随着ET-BDP-O纳米颗粒浓度的增加,其对肿瘤细胞的光动力杀伤效果不断增强,但在无外源光激活时,材料本身对细胞的毒性较低(图6(b)和6(c))。此外,对不同处理下的细胞进行PI和钙黄绿素染色,可以更直观地看出,经ET-BDP-O纳米颗粒孵育和光照后的细胞,出现大量的红色荧光信号(死细胞),进一步表明了ET-BDP-O纳米颗粒良好的光动力杀伤性能。
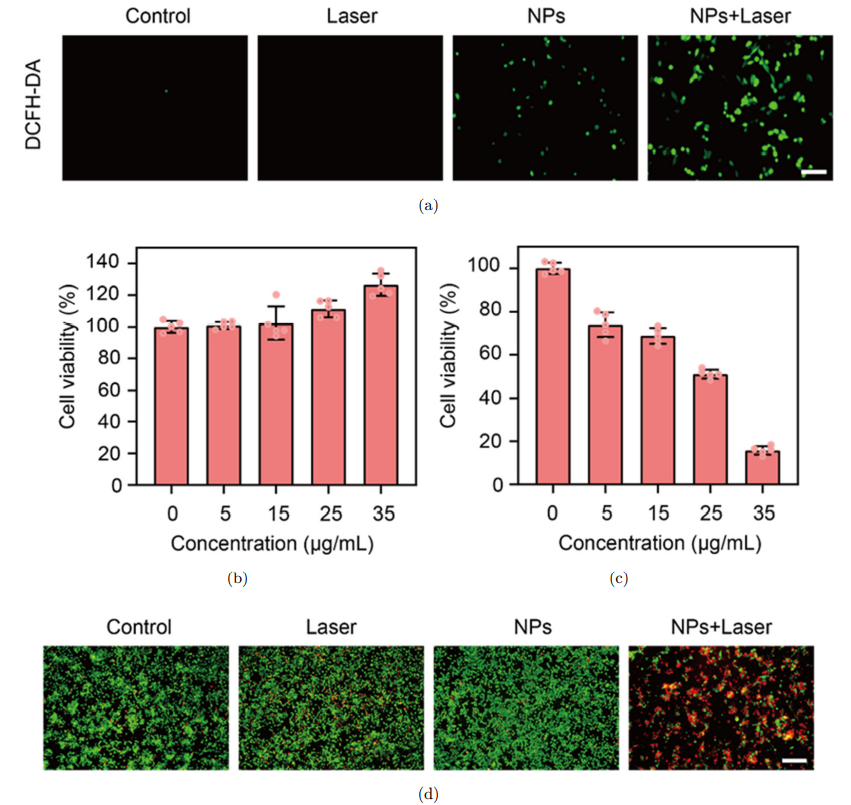
图6:(a) DCFH-DA探针检测胞内ROS的荧光图像。(b)黑暗或(c)光照下,不同浓度ET-BDP-O纳米颗粒对肿瘤细胞的杀伤情况。(d)不同处理下,细胞的PI和钙黄绿素染色分析
通讯作者简介

刘景丰,福建省肿瘤医院党委书记、福建省肝胆医学中心主任、福建省早筛早诊前沿技术重点实验室主任,教授、博导,主任医师,专业技术二级。百千万人才工程国家级人选、国务院政府特殊津贴专家、国家卫生计生突出贡献中青年专家、全国卫生计生系统先进工作者、福建省劳动模范、福建省先进工作者、福建省科技创新领军人才、福建省优秀人才。
从事普外科、肝胆外科及肝移植工作,建立和完善以肝肿瘤为主要对象的肝脏外科技术体系和以终末期肝病为对象的肝移植技术体系,对肝胆疾病的外科诊疗有较多积累。完成国家及省部级科研项目20多项,获国家科技进步二等奖1项(联合申报),省科技进步一等奖1项(第一完成人)、二等奖3项(其中第一完成人1项、第二完成人2项),国家发明专利45项,在Clinical Cancer Research、Cell Research、Advanced Science等期刊发表多篇论文,累计影响因子731,主编和参编专著9部。