JIOHS编辑部特别精选出JIOHS2018-2019年高被引文章,与读者分享。
本文介绍的是北京大学席鹏副教授课题组关于超分辨荧光偏振成像的综述,发表在《Journal of Innovative Optical Health Sciences》期刊上。
Super-resolution fluorescence polarization microscopy
Karl Zhanghao, Juntao Gao, Dayong Jin, Xuedian Zhang, and Peng Xi
https://doi.org/10.1142/S1793545817300026
研究背景
绝大部分荧光分子都是荧光偶极子,其光子吸收效率受激发光的偏振方向调制,它们发出的荧光也是偏振的。通过荧光偏振显微成像,研究者能够同时研究标记样本的结构和分子取向。然而光学衍射极限不仅约束了传统荧光偏振显微术的成像分辨率,也大大降低了荧光分子的取向探测精度。超分辨显微成像技术突破了阿贝衍射极限的约束,成功实现对纳米尺度的亚细胞结构的荧光成像,并因此获得2014年的诺贝尔化学奖。近年来,研究者将一系列超分辨成像技术与荧光偏振显微术结合,实现了纳米尺度上乃至单分子水平的荧光偶极子成像。本文我们将总结一系列传统荧光偏振显微术和超分辨荧光偏振显微术,以及它们在生物成像中的应用。
论文导读
荧光偶极子及生物结构标记
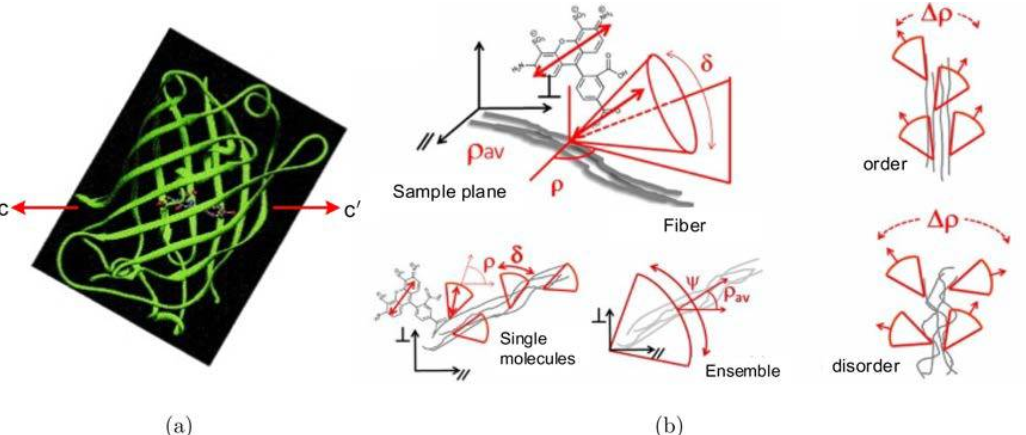
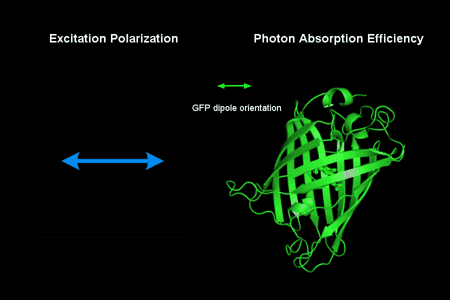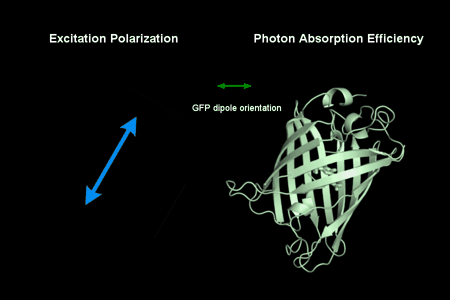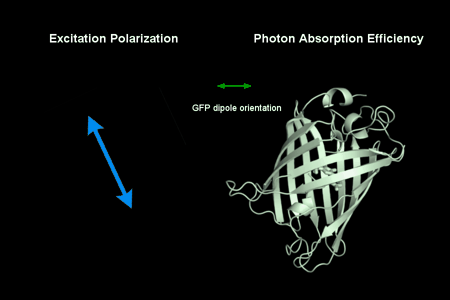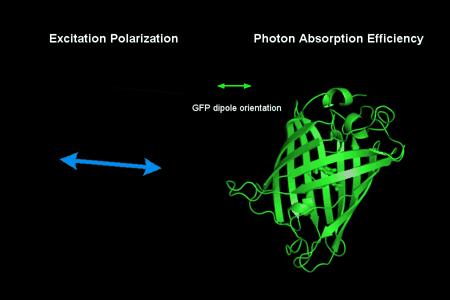
图1-荧光偶极子示意图。以绿色荧光蛋白(GFP)为例,它的偶极子取向(c-c’水平方向)与化学结构的关系如图所示。当荧光偶极子用来标记生物结构时,由于衍射极限的约束,荧光偏振显微术观察到的是衍射极限的多个荧光偶极子集合体。因此除了平均偶极子取向以外,研究者还通过集合偶极子摆动角来描述偶极子取向分布的有序无序。比如,在研究细胞膜时,集合偶极子摆动角的大小反应了脂质分子的有序性,可以进一步揭示膜的相位信息。
动图1:偏振调制下GFP荧光蛋白的光强变化。
不同原理的荧光偶极子显微术
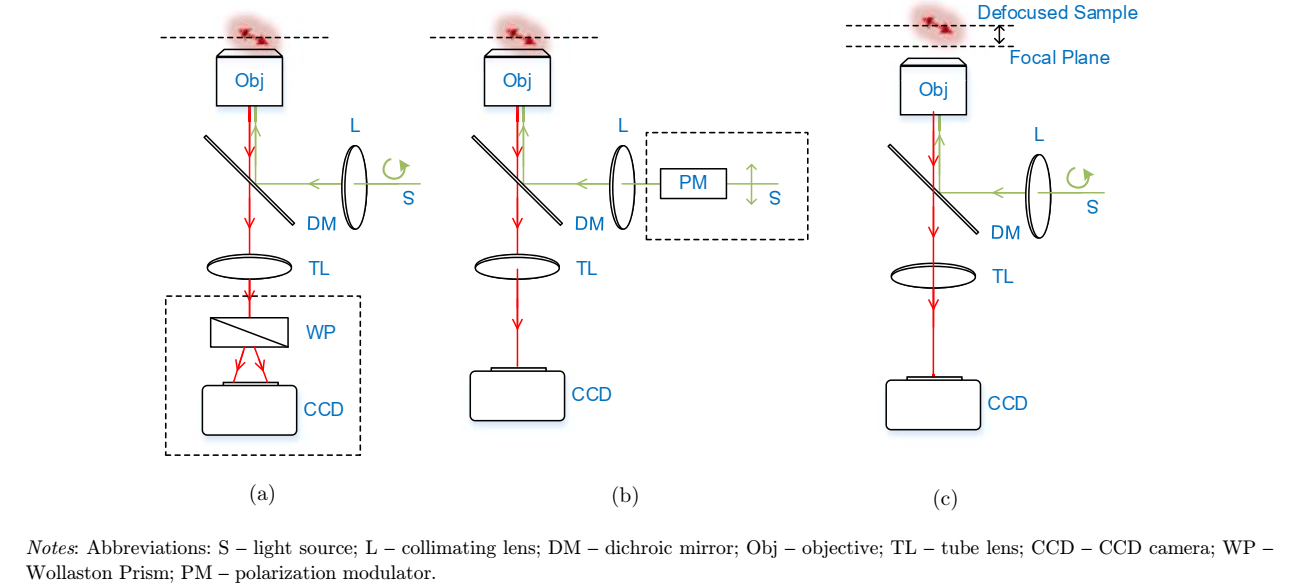
图2-三种不同的荧光偏振显微术的光路示意图。由于荧光偶极子的激发效率与激发光的偏振方向有关,因此可以通过偏振调制(又称为线性二色性)的方法来测量荧光偶极子取向,如图b所示。同时荧光偶极子发射的荧光信号也是偏振的,因此可以在探测端通过不同偏振通道来检测偶极子取向,图a中所采用Wollaston棱镜是一种产生不同偏振探测通道的方法。由于发射荧光的偏振特性,当荧光偶极子在成像中离焦时,离焦图案也会随偶极子取向变化,因此通过离焦图案识别的方法也可以检测偶极子取向,如图c所示。
不同原理的超分辨荧光偏振显微术
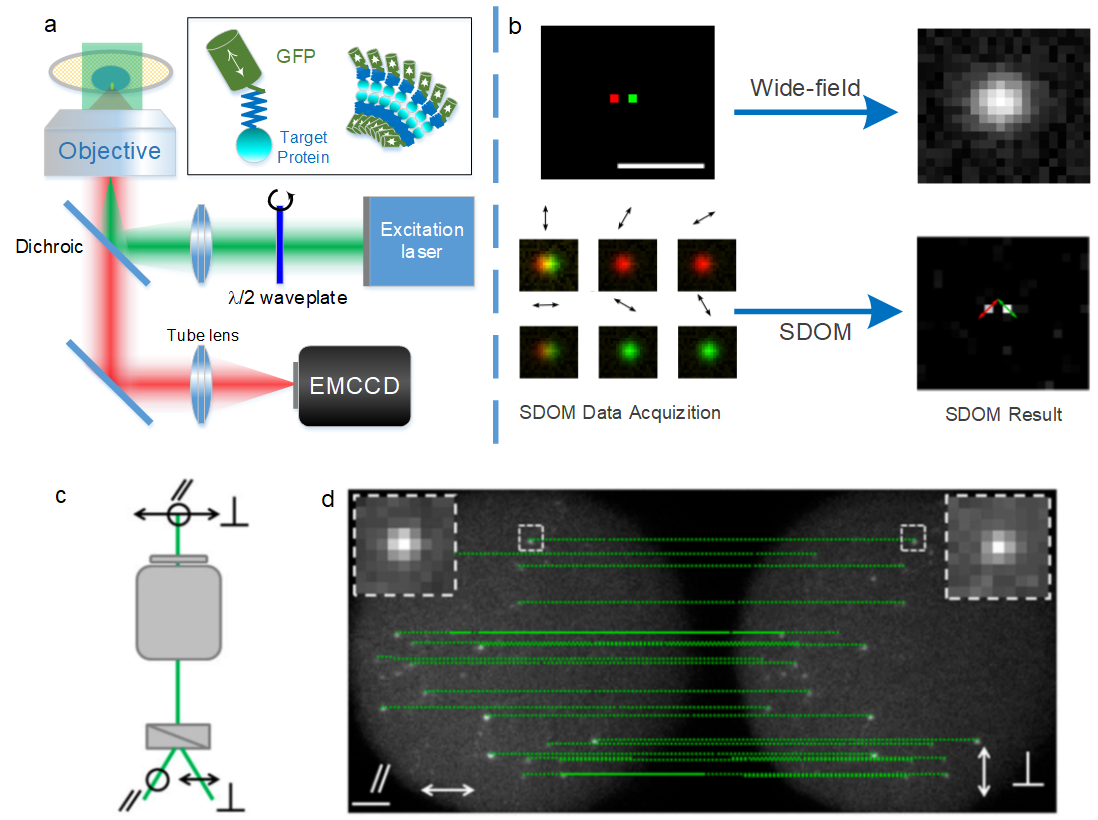
图3-两种超分辨荧光偏振显微术的原理介绍。第一种技术是超分辨荧光偶极子测绘技术(Super-resolution Dipole Orientation Mapping, SDOM)。该技术利用一个旋转半波片来调制激发光的偏振方向,并结合稀疏反卷积进行偏振解调制,从而提升荧光偶极子成像的空间分辨率和取向角度分辨率。图b通过利用简单的仿真阐释了SDOM的原理:两个很近荧光偶极子(红色和绿色代表不同的取向)在宽场下完全无法区分,看起来像是只有一个荧光团;胆汁在偏振调制的情况下,可以明显观察到左右两个偶极子先后达到最亮,最终通过偏振解调制算法我们可以同时得到这两个荧光偶极子的位置和取向。第二种技术是结合单分子成像和荧光偏振显微术,其中最简单的是在单分子显微镜的探测端采用不同探测通道(如图c所示)分别进行单分子成像和定位,通过比较同一个荧光分子不同通道的强度来得到偶极子取向。单分子荧光偏振成像的优势是能够对每一个荧光偶极子单独成像。
超分辨荧光偶极子成像结果
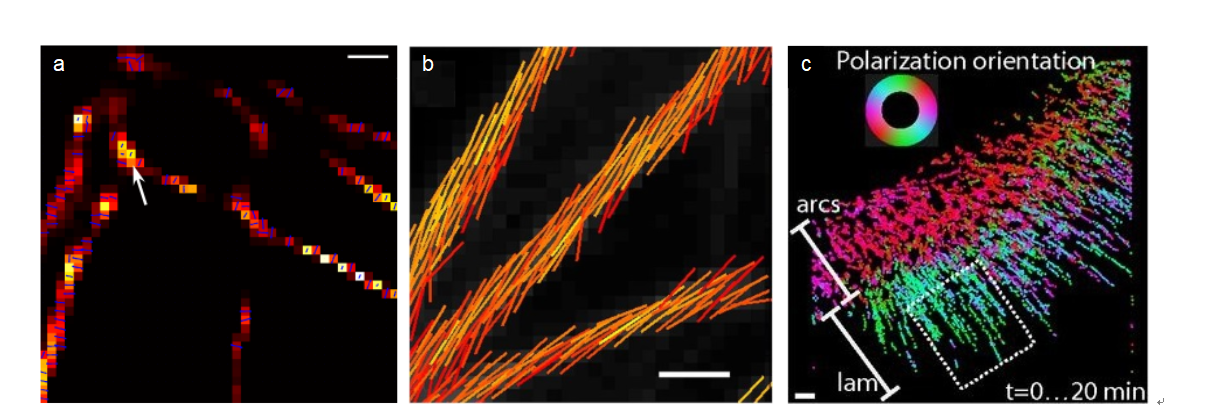
图4-不同超分辨荧光显微术对肌动蛋白纤维的成像结果。图a是SDOM技术的成像结果,图b是偏振单分子成像结果,它们的偶极子取向由线段方向表示。图c是利用单分子追踪技术对活细胞肌动蛋白的成像结果,偶极子取向有色彩表示。比例尺:a,200 nm;b,1.5 μm;c,1 μm。
最近,席鹏课题组发展了偏振结构光成像技术(pSIM),并将其应用于多种不同的细胞器成像中。为了验证这一技术与SIM的广泛兼容特性,研究人员测试了多种商用SIM系统及自主搭建的SIM平台,以及2D-SIM、3D-SIM、TIRF-SIM成像能力,成功提取荧光分子的偶极子方位信息与超分辨结构信息。同时,研究人员进行了大量的生物学实验来证明pSIM广泛的适用性,如λ-DNA、BAPE细胞和小鼠肾组织中的肌动蛋白丝、肌动蛋白和肌球蛋白之间的相互作用,以及中GFP染色的U2OS活细胞微管。
例如,在肌动蛋白actin和负责细胞输运的肌球蛋白myosin的相互作用中,研究小组发现,肌球蛋白在ATP驱动下,可以让肌动蛋白丝发生“漂移”。通过pSIM技术,可以对这一漂移的不同长度的肌动蛋白进行方向和运动的跟踪,而以往的SIM只能对其运动进行跟踪。

动图2:pSIM揭示了肌动蛋白actin和负责细胞输运的肌球蛋白myosin的相互作用。
特别是,研究小组针对神经元中的膜相关周期骨架(MPS)进行了研究。pSIM以高的空间分辨率和准确的偏振检测,揭示了肌动蛋白环在MPS中“并排”组装的新模型,推翻了以往发表在Science上的肌动蛋白环“端到端”的结构假设3, 4。pSIM具有高的时空分辨率和独特的偶极子方向信息,在未来解决各种生物问题方面具有广阔的应用前景。
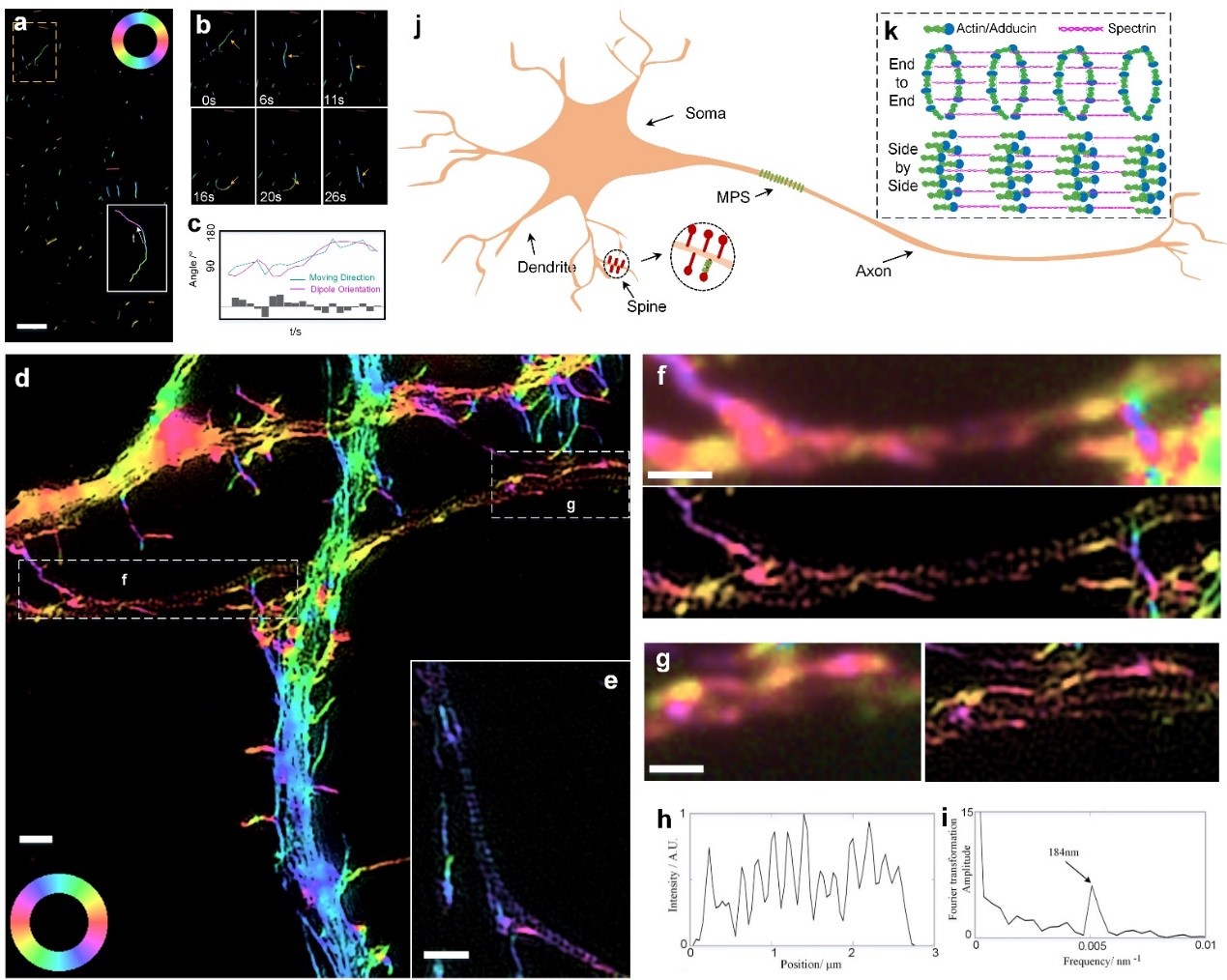
图5-pSIM揭示了肌动蛋白环在MPS中“并排”组装的新模型,推翻了以往的肌动蛋白环“端到端”的结构假设。
作者简介
张昊博士,南方科技大学研究助理教授。2017年获得北京大学-美国佐治亚理工-埃默里大学三校联合博士学位,导师为席鹏教授。开发了一系列荧光偏振技术,如:1) 利用偏振特性的荧光偶极子超分辨技术(SDOM)发表在Light: Science and Applications期刊,并得到Nature Methods的高度评价;2) 参与将SDOM应用于金纳米粒子的SERS超分辨成像(Nanoscale 2018);3)开发偏振结构光照明显微术(pSIM)并发表在Nature Communications期刊,该技术以高的空间分辨率和准确的偏振检测,揭示了肌动蛋白环在MPS中“并排”组装的新模型,推翻了以往教科书上的肌动蛋白环“端到端”的结构假设。
席鹏副教授,北京大学工学院研究员。致力于光学超分辨成像技术的研究,发展了一系列新型超分辨技术。2015年当选美国光学学会资深会员,和中国光学学会生物医学光学分会常务委员。现担任五份SCI收录国际学术期刊的编委:Light: Science and Applications, Advanced Photonics,Scientific Reports, Microscopy Research and Techniques, 和Micron。在Nature, Nature Methods等国际一流期刊发表SCI收录期刊论文60余篇。2016年获得中国光学重要成果奖。2018年获得北京市杰出青年科学基金。已授权美国专利3项,中国专利8项,编辑专著2部。多次被OSA和SPIE组织的国际会议邀请作大会邀请报告。
期刊简介
Journal of Innovative Optical Health Science (JIOHS)期刊由World Scientific Publishing Co.出版,华中科技大学武汉光电国家研究中心主任骆清铭院士担任主编,意大利Italian Institute of Technology的Colin Sheppard教授和俄罗斯Saratov State University的Valery V Tuchin教授担任期刊副主编。JIOHS期刊最新IF为1.058,且为开放获取(OA)期刊。
该刊宗旨为集中反映光电生物医学与健康工程领域的最新进展,为光子学在生物和医学领域的研究提供一个国际平台。内容包括:光子治疗学和诊断学、光学临床运用技术与系统、组织光学、激光生物组织相互作用和组织工程学、生物医学光谱学、高级显微和成像技术、纳米生物光子学和光学分子成像、多模式混合生物医学成像、微纳加工和医学微系统。
更多期刊详情可见:
http://www.worldscientific.com/worldscinet/jiohs