武汉光电国家实验室(筹)生物医学光子学功能实验室张智红教授课题组,发展了一种双靶向M2型肿瘤相关巨噬细胞(M2-like TAM)的多肽-脂质纳米颗粒(M2NP),并以M2NP为载体递送siRNA,建立了分子靶向的肿瘤免疫治疗新策略。该方法具有生物相容性好、系统性双重靶向运输、特异性剔除M2-like TAM、高效免疫激活等优点。2017年9月,研究成果以论文“A molecular-targeted immunotherapeutic strategy for melanoma via dual-targeting nanoparticles delivering small interfering RNA to tumor-associated macrophages”在线发表于ACS Nano上(http://pubs.acs.org/doi/pdf/10.1021/acsnano.7b05465) 。
以M2-like TAM为靶标细胞进行治疗,扭转由其引起的肿瘤微环境免疫抑制状态,是肿瘤免疫治疗的一个重要途径。制约这种治疗方法的瓶颈问题在于药物难以被高效地靶向运输至肿瘤微环境内的M2-like TAM。靶向性纳米颗粒为这一问题的解决带来了曙光。近年来,有报道采用甘露糖受体或叶酸受体靶向的纳米颗粒向TAM运输药物。这些方法一定程度上改变了肿瘤微环境的免疫抑制性。然而,通过这些受体靶向TAM的效率往往差强人意,而且有可能被体内执行正常功能的巨噬细胞摄取,从而有造成自身性免疫疾病的潜在风险。因此,发展特异性更高的靶向运输载体并建立分子靶向治疗策略,是针对M2-like TAM的肿瘤免疫疗法的关键。
张智红教授课题组博士研究生钱源和乔莎等人,利用TAM的M2型分化特性以及高表达清道夫受体(SR-B1)的特点,构建了具有SR-B1和M2-like TAM双靶向能力的多肽-脂质纳米颗粒(M2NP)。M2NP展现出了高效M2-like TAM 靶向能力,而被枯否细胞、肺部巨噬细胞和脾脏巨噬细胞的摄取明显弱于M2-like TAM。进而,针对M2-like TAM高表达巨噬细胞集落刺激因子受体(CSF-1R)的特征,设计与制备装载小干扰RNA的纳米颗粒siCD115-M2NP,实现了以肿瘤微环境内M2-like TAM的CSF-1R为靶标的免疫治疗策略。研究结果表明,siCD115-M2NP在特异性剔除M2-like TAM的同时,扭转了肿瘤内的免疫抑制环境,增强了CD8+ T细胞的浸润并激活了其功能,明显抑制了黑色素瘤的生长并延长了实验动物的生存时间。由于CSF-1R在M2-like TAM中的表达水平明显高于其他组织器官中的巨噬细胞,因此这一疗法对执行正常生理功能的巨噬细胞几乎没有影响,体现了细胞与分子双重靶向的优势。
该研究得到了国家自然科学基金重大研究计划(No. 91442201),国家杰出青年科学基金(No. 81625012),国家自然科学基金创新研究群体科学基金(No. 61421064)和武汉光电国家实验室(筹)主任基金等项目的支持。
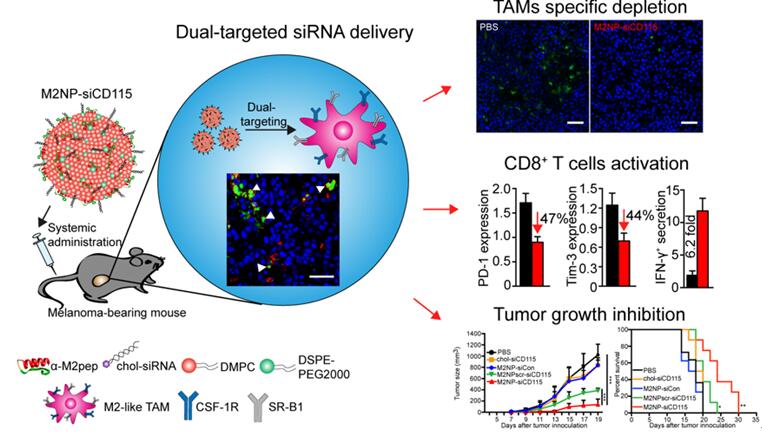
图. M2-like TAMs双靶向原理图和免疫激活与肿瘤免疫治疗效果图