拉曼光谱的精细结构可以提供丰富的分子结构信息,并且可以用于解析分子的动力学以及与溶剂环境的相互作用。然而遗憾的是,拉曼散射过程异常微弱,普通拉曼散射的散射截面比一般染料分子的吸收截面要小1014倍。通过表面等离子体共振对光场的放大,表面增强拉曼光谱技术可以实现单分子灵敏度的拉曼检测。然而这种表面增强技术需要精确接触纳米金属颗粒的近场激发技术,目前还无法做到精准的定量分析,并且很难应用到诸如活体显微成像等非接触测量领域。因此,如何实现远场具有单分子灵敏度的拉曼成像一直是近几十年来光谱领域的夙愿。而哥伦比亚大学闵玮教授课题组近期发表在Nature Photonics 上的研究成果使得这一夙愿成为现实。
放大拉曼信号的远场光学策略大致可分为两种。其一是使用受激辐射光放大的原理,是诸如受激拉曼散射等相干拉曼散射的放大机理;其二是通过电子能级共振实现协同放大,是共振拉曼光谱的增益来源。在哥伦比亚大学化学系闵玮教授课题组2017年的论文(Nature, 2017, 544, 465,点击阅读详细)中,通过结合光学显微术跟这两种拉曼放大机理一起,可以实现对染料分子低至约250-nM的远场拉曼检测,换算到分子数,约为30到50个分子的灵敏度。所以实现远场单分子拉曼检测看似只差“临门一脚”。然而,受激拉曼散射技术通过检测拉曼散射对泵浦激光强度的调制实现信号检测,就不可避免的面临强的泵浦激光散粒噪声的干扰。而目前并没用有效地减弱光场散粒噪声的方法。这对于受激拉曼散射技术来说看似“临门一脚”的距离,却成为难于逾越的鸿沟。
然而光谱领域对于规避巨大的激光散粒噪声其实早有经验。那就是使用和泵浦激光有波长差异的光场作为信号读出通道。荧光信号因为巨大的斯托克斯位移,被作为最佳读出通道选择。事实上,单分子荧光光谱与成像在化学和生物学里的巨大成功和影响力也得益于此。因而,闵玮教授课题组意识到,如果能将拉曼信号与荧光信号耦合起来,可能能够解决这最后的灵敏度问题。早在1980年,John C. Wright 等人就提出如图1A所示的激发策略:先通过受激拉曼散射过程将分子泵浦到位于电子能级基态的振动激发态,再通过一束超快激光将分子从振动激发态激发到电子能级的第一激发态。由于三束激光各自的能量都不足以将分子激发到电子能级第一激发态,只有在振动能级共振时,才有可能激发荧光。所以荧光信号的激发光谱将会携带振动能级的拉曼谱特征。然而遗憾的是,这种方法历史上唯一一次在1983年的实验报道却是失败的。实验结果显示,非线性双光子激发产生巨大的荧光背景,以至于无法在激发谱上读出拉曼谱线。
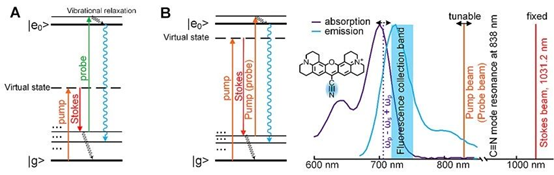
图1. 受激拉曼激发荧光示意图。(A)由Wright等人于1980年提出的三光束双共振荧光激发示意图。(B)由闵玮课题组提出的基于电子预共振的受激拉曼激发荧光示意图。左边为激发示意图,右边为对实际染料分子Rhodamine 800 氰基模式激发的激光配置示意图。图片来源:Nat. Photon.
意识到Wright等人的尝试都是在非电子共振的状态进行的,利用电子共振协同放大可以将拉曼泵浦过程的效率提高几个数量级,闵玮教授课题组通过理论分析发现,如果采取精确的电子预共振状态,这种策略将变得可行,通过受激拉曼过程介导的荧光信号将不再被双光子荧光背景淹没。图1B显示了在电子预共振状态下新的激发示意图。值得注意的是,在电子预共振情况下,用于受激拉曼泵浦的泵浦光也可以将分子从振动激发态激发到电子激发态,从而将系统由三光束系统简化为双光束系统,大大的简化了试验。
使用这种新的受激拉曼激发荧光策略,研究人员第一次演示对Rhodamine 800 氰基振动模式进行激发的试验。实验结果显示,当泵浦激光调谐扫过氰基的共振频率时,荧光的激发谱清晰的显示了约10个波数带宽的氰基振动谱线(图2A),线性完美的映射了受激拉曼散射的谱线。然而相比于受激拉曼散射而言,由于不再受巨大的激光散粒噪声的干扰,相同信号积分时间下,受激拉曼激发荧光的灵敏度要高出两个数量级以上。得益于荧光检测优异的灵敏度,研究人员进一步演示了单分子受激拉曼荧光成像,实验中,首先通过标准单分子荧光对分子的位置进行确认,然后通过调谐泵浦激光对该分子进行多次成像,成像结果清晰的显示,当泵浦激光处于拉曼共振频率时,探测到的荧光信号最大(图2B),从而第一次实现全远场模式下的单分子拉曼成像。
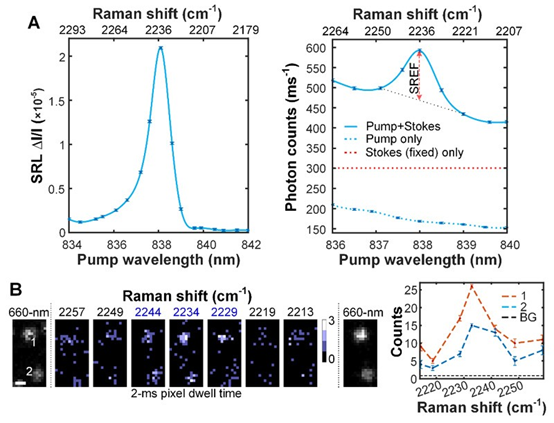
图2. 受激拉曼激发荧光在Rhodamine 800上的演示结果。(A)溶液测量结果。左图为1-mM Rhodamine 800 二甲亚砜溶液受激拉曼散射光谱组为参考;右图为500-nM Rhodamine 800 二甲亚砜溶液受激拉曼散射激发荧光光谱。(B)Rhodamine 800单分子受激拉曼激发荧光显微成像。图片来源:Nat. Photon.
拉曼光谱相比于荧光光谱而言具有更高的化学特异性。研究人员通过将Rhodamine 800的氰基用不同的氮元素和碳元素组合进行替换,合成出吸收和荧光光谱在室温下完全相同,但是氰基拉曼光谱相互分离的四种同位素分子。虽然通过普通荧光光谱技术无法区分,但是在受激拉曼激发荧光下可以很轻松的区分。实验中,被不同同位素分子染色的大肠杆菌可以在受激拉曼激发荧光显微成像下轻松的识别开(图3)。该方法兼具荧光探测的高灵敏度与拉曼成像的高光谱分辨率,研究人员预期,受激拉曼激发荧光将打破普通荧光成像通道数的限制,在多色成像领域大放异彩。
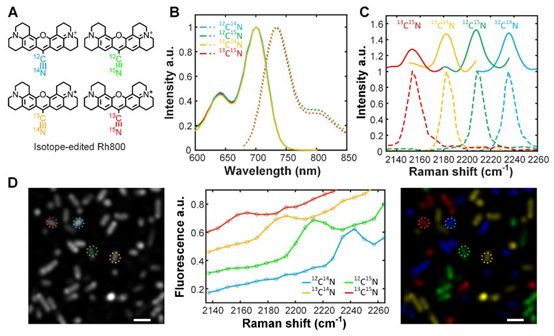
图3. Rhodamine 800 的四种氰基同位素分子受激拉曼激发荧光光谱与显微成像结果。(A)分子的结构。(B)四种同位素分子的吸收与荧光光谱。(C)四种同位素分子受激拉曼激发荧光光谱,虚线为受激拉曼散射光谱作为参照。(D)被四种分子分别染色的大肠杆菌受激拉曼激发荧光显微成像。图片来源:Nat. Photon.
闵玮教授课题组的博士生熊汗青和施立雪为该工作的共同第一作者。其中熊汗青同学先后于华中科技大学生物医学工程系和武汉光电国家实验室获得学士学位和硕士学位,并于2015年加入闵玮教授课题组。施立雪同学于北京大学化学系获得学士学位,并于2014年加入闵玮教授课题组。美国化学会的C&EN 也以“Spectroscopy method combines the best of Raman and fluorescence”为题做了相应的报道 [1]。
原文(扫描或长按二维码,识别后直达原文页面):

Stimulated Raman excited fluorescence spectroscopy and imaging
Hanqing Xiong, Lixue Shi, Lu Wei, Yihui Shen, Rong Long, Zhilun Zhao, Wei Min
Nat. Photon., 2019, DOI: 10.1038/s41566-019-0396-4
导师介绍
闵玮
https://www.x-mol.com/university/faculty/1407