近日,华中科技大学武汉光电国家研究中心张智红教授团队在国际期刊 Advanced Science 上发表题为《Melittin-Carrying Nanoparticle Suppress T Cell-Driven Immunity in a Murine Allergic Dermatitis Model》的研究论文。该研究受中医蜂毒治疗过敏性疾病的启发,开发了一种基于蜂毒主要成分蜂毒肽的纳米免疫疗法,在屏蔽了蜂毒注射引起的皮肤局部损伤的同时,对过敏性接触性皮炎和异位性皮炎疗效显著。其免疫学机制主要是通过靶向调节淋巴结DC,抑制过敏原诱导的DC成熟以实现对抗原特异性T细胞增殖和活化的抑制(图1)。该研究为过敏性皮肤疾病的治疗提供了新思路。
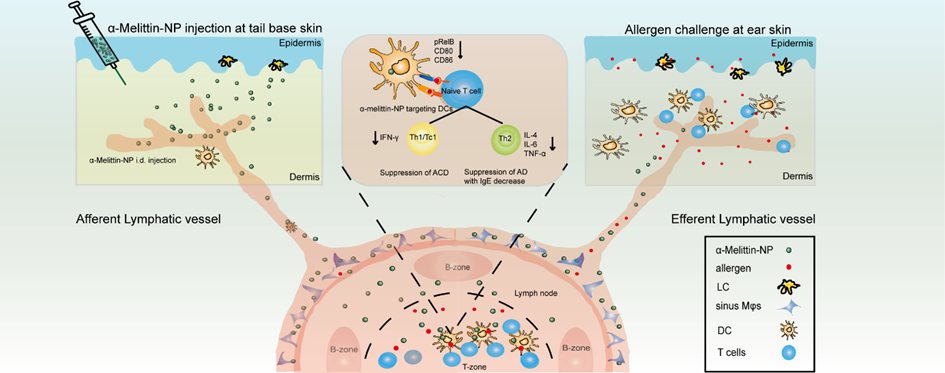
图1. α-Melittin-NP的免疫调控机制示意图
过敏性皮肤疾病,包括接触性皮炎(ACD)和特应性皮炎(AD),是顽固的免疫性皮肤疾病,其反复发作的特性使患者的生活质量大大降低。其中接触性皮炎主要由Th1细胞介导,而特应性皮炎主要由Th2细胞介导。据估计,2019年全球范围内特应性皮炎患者已超过六亿人,其中中国特应性皮炎患者超过六千万人。尽管皮质类固醇激素是过敏性皮肤炎症的常见治疗药物,但过度使用激素治疗也会诱发毒副作用,这使得研究者们开始寻找替代性的治疗方案。传统中医的蜂毒疗法曾被尝试用于过敏性疾病和皮肤炎症的治疗,但是由于蜂毒本身成分复杂,局部注射毒性较大,治疗机理不明等原因,限制了蜂毒在临床过敏性皮肤疾病中的应用。近年来,纳米免疫材料诱导机体免疫耐受是纳米免疫治疗中备受关注的领域,为自身免疫性疾病的治疗带来了新的思路。特别是基于靶向和重编程树突状细胞的纳米材料的设计,为机体诱导免疫耐受及治疗过敏性皮肤疾病提供了新策略。
首先研究者通过使用半抗原OXA诱导小鼠ACD来研究蜂毒肽(melittin)对过敏性皮肤疾病的治疗效果。通过皮内给药低剂量的melittin,研究者发现melittin有效缓解了ACD疾病模型小鼠的炎症症状(图2A-B)。尽管melittin在皮内注射展现了一定的治疗效果,但是直接皮内注射melittin会引起局部皮损,注射部位有大量白细胞浸润,而皮内注射相同剂量的α-Melittin-NP(以melittin浓度定量的多肽-脂性纳米颗粒)则显著改善了局部炎症,相比于直接注射melittin,皮内注射α-Melittin-NP的安全性更高。进一步的研究结果确认α-Melittin-NP有效缓解了ACD疾病模型小鼠的炎症症状(图2C),炎症区域皮肤水肿减轻,淋巴细胞浸润下降,炎症因子IL-1β水平降低,而α-Peptide-NP和PBS处理组在炎症程度上无显著差异。重要的是,α-Melittin-NP治疗后,血清中Th1型关键细胞因子IFN-γ分泌减少,且在控制IFN-γ分泌上α-Melittin-NP比单独Melittin的疗效更优。这些结果表明相较于melittin单独给药,α-Melittin-NP皮内注射治疗过敏性皮肤疾病效果更佳且更为安全。
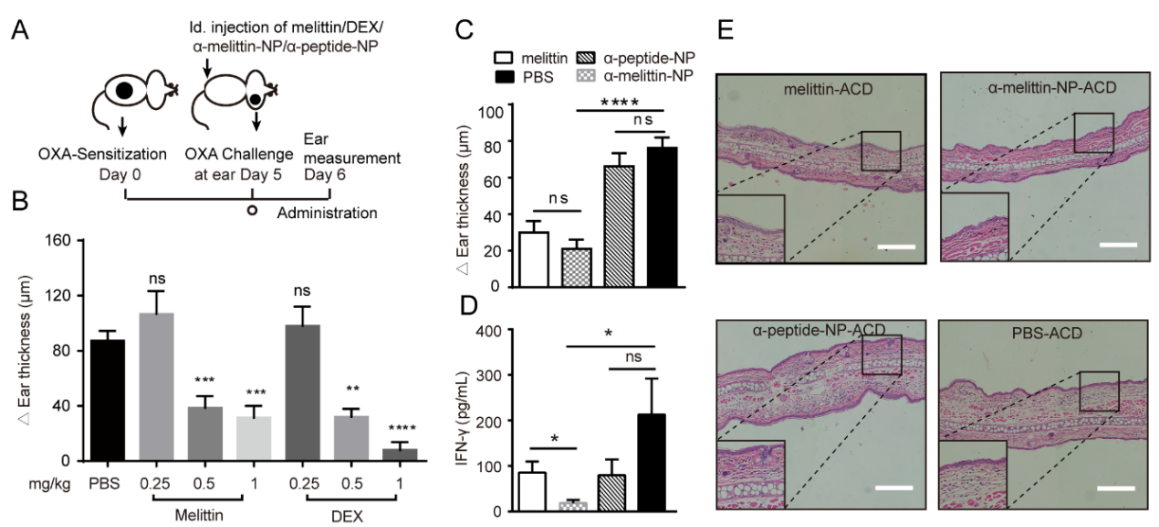
图2. α-Melittin-NP有效抑制ACD。(A)半抗原OXA诱导的CHS模型示意图。(B)不同剂量Melittin和DEX对于CHS反应的抑制作用,使用耳廓皮肤肿胀程度来表征炎症程度。(C)α-Melittin-NP、melittin、α-Peptide-NP及PBS治疗CHS的效果对比,测量耳廓的肿胀变化。(D)四组药物处理后血清中IFN-γ的分泌水平。(E)四组药物处理后CHS模型小鼠的耳廓皮肤H&E切片,比较白细胞浸润程度及耳廓肿胀变化。
进一步,研究者探索了α-Melittin-NP对另外一种主要由Th2细胞介导的疾病AD是否有效。研究者发现α-Melittin-NP皮内给药也能显著抑制AD所引起的皮肤肿胀。如图3A-B所示,相较于PBS给药组小鼠,α-Melittin-NP治疗组抑制了82.1%的整体皮肤肿胀,与激素的治疗效果相当,高于单独Melittin的治疗效果。表皮增生是AD的重要特征之一,而α-Melittin-NP治疗组在控制表皮增生方面效果良好。如图3 D所示,α-Melittin-NP治疗组小鼠的平均表皮增生为18.6 μm左右,而PBS组的表皮增生为67.2 μm左右。除了表皮增生,血清IgE的分泌水平也是衡量AD过敏炎症程度的重要指标,如图3E所示,α-Melittin-NP治疗组的IgE分泌水平下降了56.6%,DEX治疗组IgE分泌下调了38.9%。局部炎症皮肤中检测到AD造模组的IL-4、IL-6、TNF-α相较于正常小鼠显著上升。如图3F-J所展示的使用各组药物处理后AD小鼠炎症皮肤局部的Th2因子变化。α-Melittin-NP、melittin及DEX处理组均能有效控制皮肤中IL-4、IL-6、TNF-α的表达水平,相较于PBS-AD组,α-Melittin-NP治疗组IL-4下降了91.9%(图2F),IL-6下降了59.7%(图3G),TNF-α下降了40.8%(图3H)。这些结果表明α-Melittin-NP在AD模型中能较好的控制Th2因子的原位释放,且在控制IgE水平上优于单独Melittin给药。
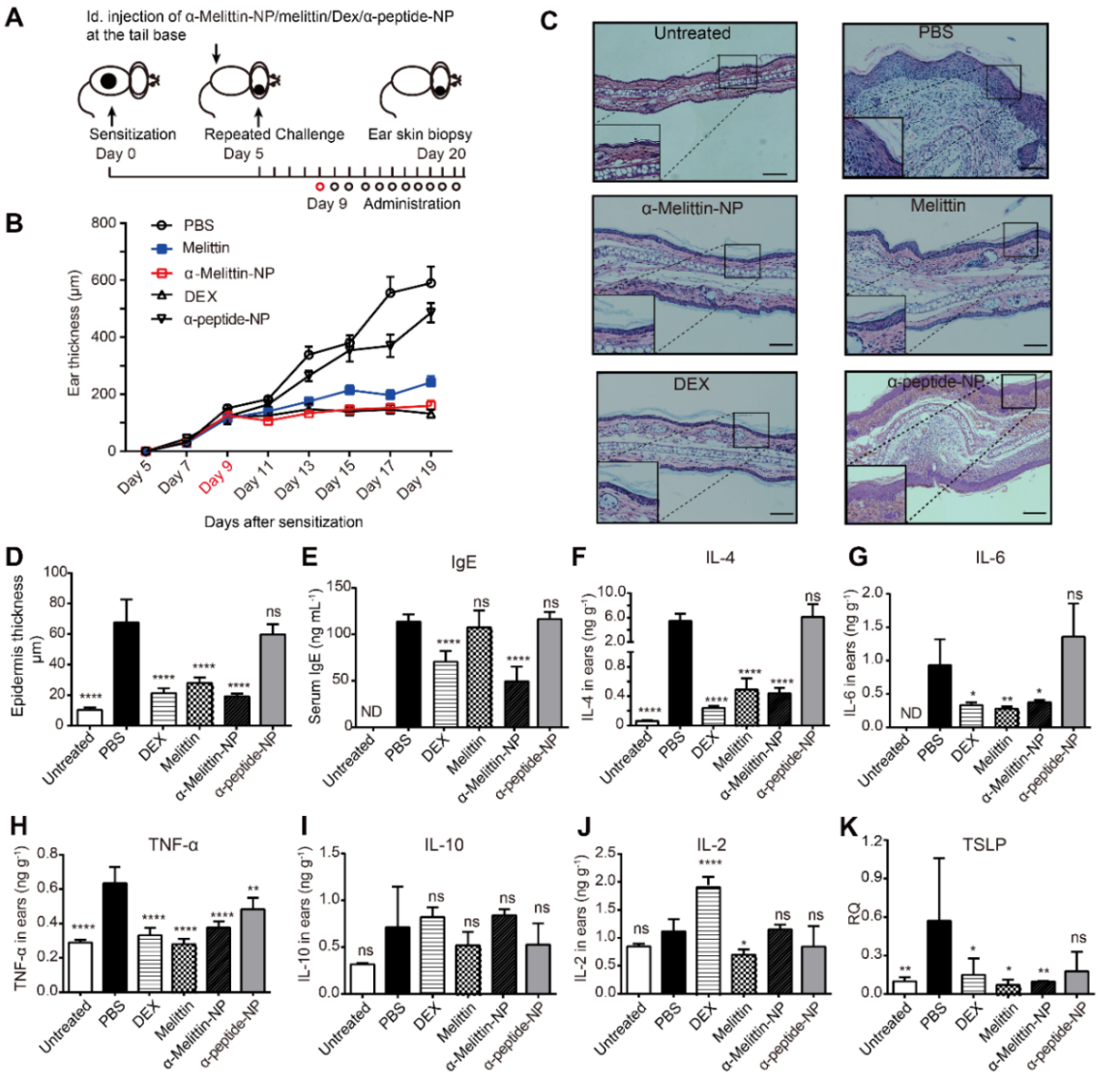
图3. α-Melittin-NP有效抑制AD。(A)半抗原OXA诱导的AD模型示意图。(B)α-Melittin-NP、α-Peptide-NP、Melittin、DEX以及PBS五组药物处理对AD的治疗效果。(C)H&E切片表征五组药物处理后耳廓皮肤的白细胞浸润结果。(D-K)五组药物处理后,AD小鼠耳廓皮肤的表皮厚度,血清IgE浓度及皮肤中IL-4、IL-6、TNF-α、IL-10、IL-2以及TSLP的表达水平。
紧接着文章探究了蜂毒肽纳米颗粒治疗过敏性皮炎的机制。通过整体荧光成像,研究者首先确定了皮内注射α-Melittin-NP能有效靶向皮肤引流淋巴结,并且不会额外蓄积在肝脏以外的脏器。通过对淋巴结内细胞进行流式细胞术检测,研究者确认α-Melittin-NP主要由淋巴结T细胞区域内CD11c+的DC细胞摄取,T细胞和B细胞吞噬比例较低。进一步对DC的成熟与活化表征,研究者发现在OXA诱导的ACD小鼠中使用α-Melittin-NP能显著抑制DC激活,在离体实验中DNBS和LPS诱导的BMDC的成熟和活化也均能被α-Melittin-NP有效抑制(图4)。
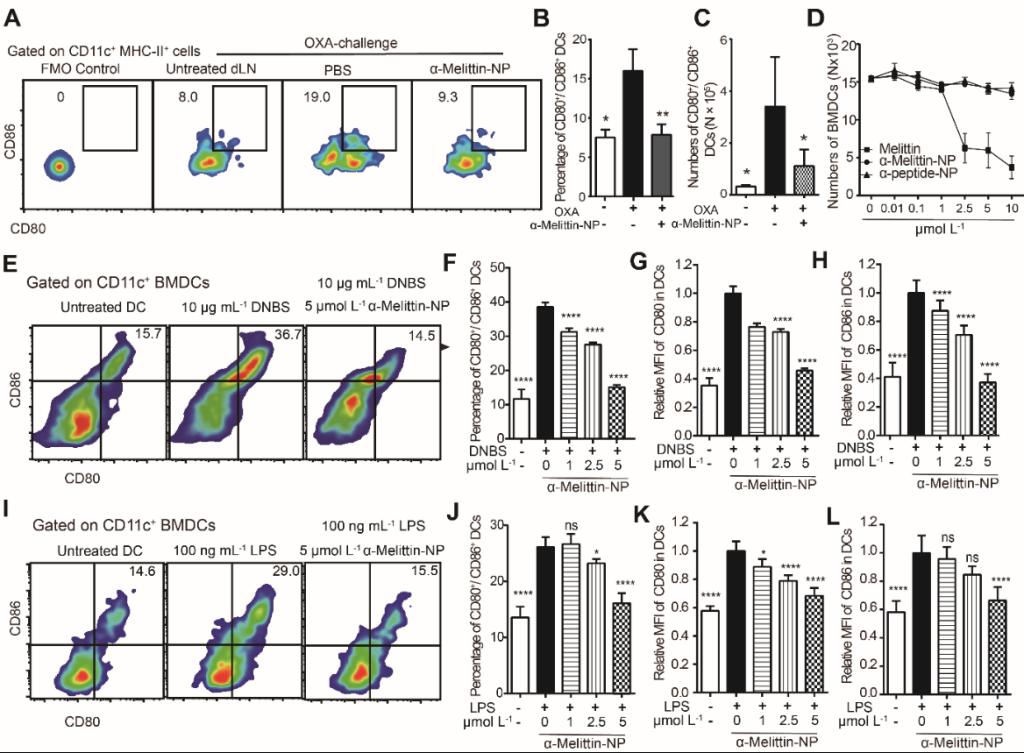
图4. α-Melittin-NP抑制DC成熟活化的活体和体外研究。(A-B)图为代表性的流式细胞图及CD80/CD86双阳性DC细胞群体比例量化统计结果。(C)图为(A)中CD80/CD86双阳性DC细胞总数统计结果。(D)图展示了使用不同梯度(0-10 μM)的α-Melittin-NP、α-Peptide-NP及Melittin处理后离体检测的BMDC活细胞数目。(E-H)α-Melittin-NP抑制过敏原DNBS体外诱导的BMDC成熟与活化。(E-H)α-Melittin-NP抑制LPS体外诱导的BMDC成熟与活化。
在确定α-Melittin-NP抑制过敏原诱导的DC成熟后,研究者进一步探索了纳米颗粒是否能通过影响DC活化以阻碍DC-T细胞间的抗原识别过程。二硝基氟苯水合物(DNBS)诱导的淋巴细胞增殖实验(图5A-H)表明,相比于对照组,使用α-Melittin-NP孵育淋巴细胞后,DNBS诱导的CD8+T细胞的增殖群体比例降低了92%。此外,检测淋巴细胞培养基上清中IFN-γ的分泌水平,α-Melittin-NP孵育也显著下调了IFN-γ的表达,上清中IFN-γ浓度从PBS组的626.4 pg·mL-1降至398.5 pg·mL-1(图5C)。接着,研究者在活体水平也检测了α-Melittin-NP对半抗原特异性CD8+T细胞活化的影响。如图5D-E所示,在OXA诱导ACD小鼠后皮内注射α-Melittin-NP,之后检测其CD8+T细胞的活化情况。结果显示,相较于PBS治疗组,α-Melittin-NP治疗组显著降低了CD8+T细胞的IFN-γ分泌,其IFN-γ阳性CD8+T细胞群体比例从9.5%降至3.5%。证实了α-Melittin-NP在活体和离体均能抑制不同种类的半抗原特异性T细胞的活化。此外,进一步的研究表明α-Melittin-NP对蛋白抗原OVA诱导的抗原特异性CD8+T细胞增殖具有相似的抑制效果(图5F-H)。这证明了α-Melittin-NP不仅对半抗原特异性效应T细胞增殖有抑制作用,也能影响抗原特异性的T细胞增殖。
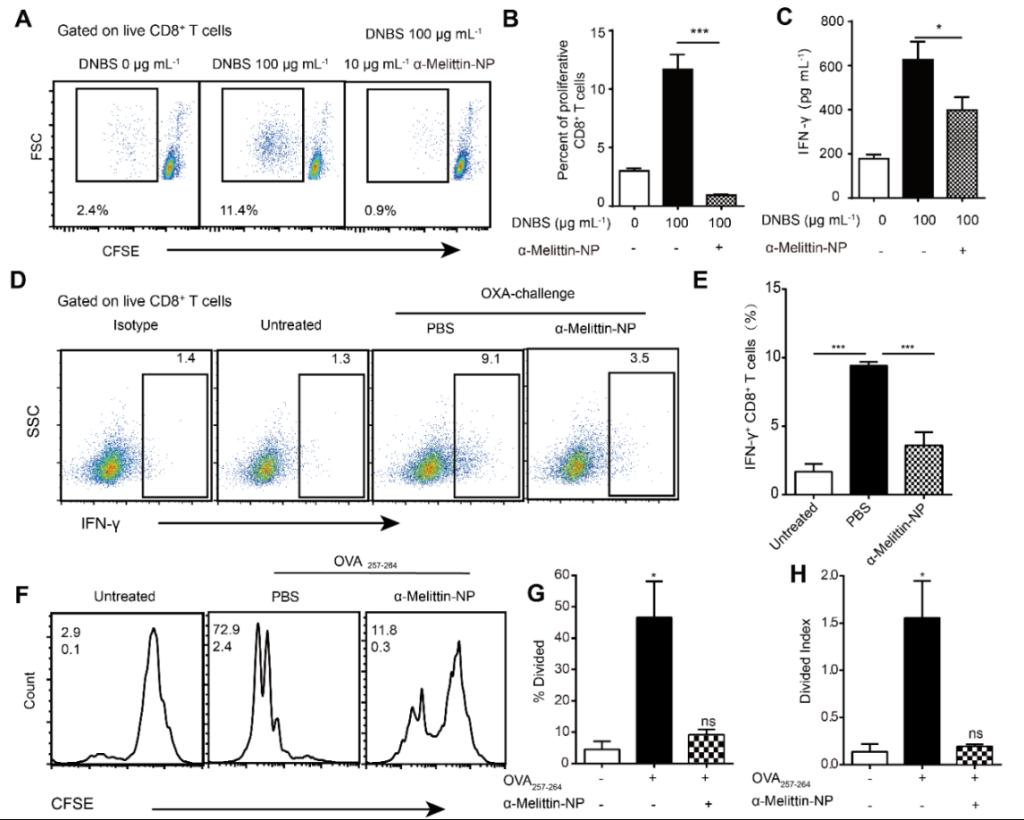
图5. α-Melittin-NP抑制半抗原DNBS特异性的CD8+T细胞增殖及活化。(A-C)使用DNFB致敏的小鼠CD8+T细胞增殖与活化的流式图和统计结果。(D-E)正常小鼠及使用α-Melittin-NP 或者PBS治疗的OXA致敏造模小鼠引流淋巴结中表达IFN-γ的CD8+T细胞群体的代表性流式细胞图及统计结果。(F-H)使用α-Melittin-NP及PBS孵育的抗原OVA257-264刺激的CD8 T细胞增殖的流式细胞峰形图,细胞分裂指数(Divided Index)和细胞分裂指数(Divided Index)的量化统计柱形图。
综上所述,基于α-Melittin-NP的纳米免疫疗法,通过靶向调控淋巴结DC,进而抑制过敏原诱导的DC成熟与活化来调控T细胞增殖与活化,实现抑制T细胞介导的过敏性皮肤免疫应答。该策略为过敏性皮炎的治疗提供了新的治疗思路。该研究得到国家重点研发计划(2017YFA0700403)、国家自然科学基金(91842305, 91842307, 81901691)、武汉光电国家研究中心创新基金和海南大学科研基金 (KYQD(ZR)20078)的资助。华中科技大学武汉光电国家研究中心张智红教授为本文的通讯作者,课题组博士后刘征和博士研究生范展为文章的共同第一作者,课题组成员刘金鑫、徐梦丽、王佳璐、李鑫琳、许逸伦、鲁亚芳、韩晨露共同参与了相关工作。
全文链接:https://doi.org/10.1002/advs.202204184